Содержание
-
Слайд 1
Работу выполнила студентка института химии 2 курса 213 группы: Никитина Наталья
-
Слайд 2
Постулаты Бора — основные допущения, сформулированные Нильсом Бором в 1913 году для объяснения закономерности линейчатого спектра атома водорода и водородоподобных ионов и квантового характера испускания и поглощения света. Бор исходил из планетарной модели атома Резерфорда
-
Слайд 3
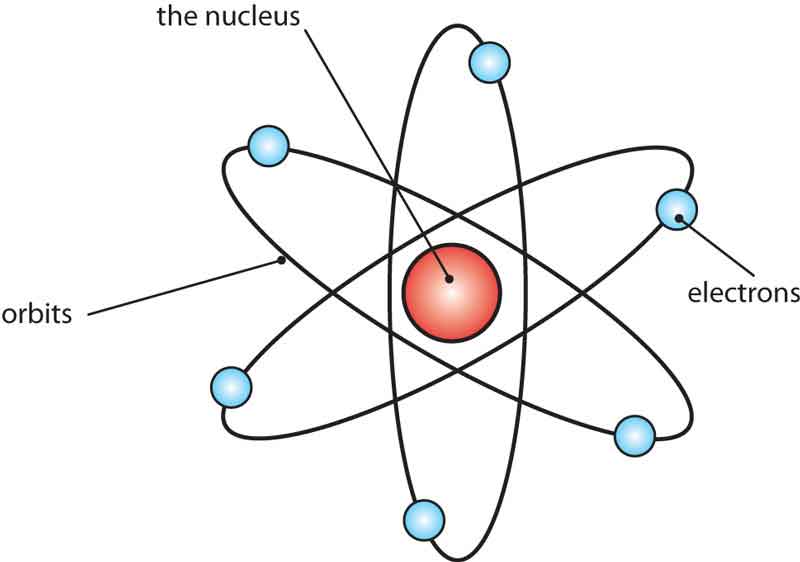
В атоме существуют стационарные квантовые состояния, не изменяющиеся с течением времени без внешнего воздействия на атом.В этих состояниях атом не излучает электромагнитных волн, хотя и движется с ускорением.Каждому стационарному состоянию атома соответствует определенная энергия атома.Стационарным состояниям соответствуют стационарные орбиты, по которым движутся электроны.
-
Слайд 4
II ПОСТУЛАТ — ПОСТУЛАТ квантования МОМЕНТА ДВИЖЕНИЯ ЭЛЕКТРОНА НА ОРБИТЕ
В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные, квантовые значения момента импульса.
Квантование-придание физическим величинам в микро мире дискретного набора значений.
Правило квантования Бора позволяет вычислить радиусы стационарных орбит электрона в атоме водорода и определить значения энергий.
me- масса электрона,
υ – скорость электрона
rn – радиус стационарной круговой орбиты -
Слайд 5
III постулат — правило частот:
При переходе атома из одного стационарного состояния в другое излучается или поглощается 1 фотон.а) Атом излучает 1 фотон(который несет 1 квант энергии), когда электрон переходит из состояния с большей энергией (Е k) в состояние с меньшей энергией (Е n).
Энергия излученного фотона: Частота излучения:Здесь (Ek — En) — разность энергий стационарных состояний.При Ек > Eп происходит излучение фотона.
где k и n — номера стационарных состоянии, или главные квантовые числа. -
Слайд 6
б) Атом поглощает 1 фотон, когда переходит из стационарного состояния с меньшей энергией (E n) в стационарное состояние с большей энергией (E k).При Ек
-
Слайд 7
Энергетические диаграммы
Возбужденное состояние
Е4>Е3>Е2>Е1Переход атома
Энергетический уровень (стационарное состояние)
Нормальное состояние атома
Е1 — минимальная энергияЕ1
Е2
Е3
Е4
Е,эВ -
Слайд 8
Свои постулаты Н. Бор применил для построения теории строения простейшего атома (атома водорода).Согласно этой теории Бор смог вычислить для атома водорода:- возможные радиусы орбит электрона и размеры атома- энергии стационарных состояний атома- частоты излучаемых и поглощаемых электромагнитных волн.
-
Слайд 9
Модель атома водорода по Бору
-
Слайд 10
-
Слайд 11
-
Слайд 12
Демонстрация диаграммы энергетических уровней атома некоторых элементов
-
Слайд 13
Распределение энергетических уровней при излучении (испускании) и поглощении атомом водорода электромагнитных волн:
При (n = 1) — основное энергетическое состояние, ему соответствует радиус орбиты электрона r = 0,5 • 10 -11 м. При (n больше 1) — возбужденные состояния.При поглощении атомом кванта энергии (фотона) атом переходит в возбужденное состояние, при этом электрон переходит на более отдаленную орбиту и его связь с ядром слабеет.
-
Слайд 14
Объясняет строение атома водорода и водородоподобных атомов
Существование спектральных серий: Лаймана, Бальмара, Пашина, Брекета, и Пфунда
Опыты Франка и Герца -
Слайд 15
Опыты Франка — Герца
Рис. 1. Схема опыта Франка — Герца. В сосуде Л находятся пары ртути при давлении 1 мм. рт. ст. К — накаливаемый катод, С1 и С2 — ускоряющая и замедляющая сетки, А — анод. Ток регистрируется гальванометром Г.
Рис. 2. Зависимость силы тока от величины ускоряющего потенциала I(V) в опыте Франка — Герца
-
Слайд 16
Является половинчатой (были использованы законы классической механики и квантовые постулаты)
Постулаты Бора являются следствием квантовой механики и электродинамики
Правило квантования Бора применяется не всегда
Электроны не имеют определенных орбит, как в теории Бора -
Слайд 17
Использованные источники:
1. www.myshared.ru/slide/136618
2. http://pptcloud.ru/shkola/fizika/library/prezentaciya-uroka-postulaty-bora-0
3. http://class-fizika.narod.ru/at2.htm
4. http://www.uchportal.ru/load/40-1-0-6937
5. http://www.physics.ru/courses/op25part2/content/chapter6/section/paragraph2/theory.html
6. http://av-physics.narod.ru/atom/quantum-postulates.htm
Посмотреть все слайды
Открытие электрона
Излучение внутри трубки Крукса не могло быть волнами, так как оно несло отрицательный заряд. Джозеф Джон Томсон (1856-1940) пришел к ответу в 1887 году, когда он обнаружил связь между зарядом и массой этого излучения и обнаружил, что она всегда одинакова: 1,76 x 1011 C / кг., Независимо от газа, заключенного в трубке, или материала, из которого изготовлен катод.
Томсон назвал эти частицы тельца. Измеряя ее массу по отношению к ее электрическому заряду, он пришел к выводу, что каждая корпускула была значительно меньше атома. Поэтому он предположил, что они должны быть их частью, открыв тем самым электрон.
Британский ученый первым набросал графическую модель атома, нарисовав сферу со вставленными точками, которая из-за своей формы получила прозвище «сливовый пудинг». Но это открытие вызвало другие вопросы:
- Если материя нейтральна, а электрон имеет отрицательный заряд: где в атоме положительный заряд, нейтрализующий электроны?
- Если масса электрона меньше массы атома, то из чего состоит остальная часть атома?
- Почему полученные таким образом частицы всегда были электронами, а не каким-либо другим?
Проблемы планетарной модели
Планетарная модель атома Резерфорда объяснила опыт по рассеянию альфа-частиц, однако, она противоречила электродинамике Максвелла, согласно которой заряд, движущийся с ускорением, должен излучать электромагнитные волны. Электрон, двигаясь по круговой орбите, имеет постоянное центростремительное ускорение, а значит, должен излучать, теряя энергию, и в конце концов, должен упасть на ядро. Расчеты показывали, что это должно происходить очень быстро. Однако, в реальности атомы устойчивы. Данное затруднение было преодолено только с развитием квантовой физики.
Что мы узнали?
Открытие электрона показало, что атом имеет сложную структуру. В результате опытов Э.Резерфорда была предложена планетарная модель строения атома, где весь положительный заряд и почти вся масса сосредоточена в ядре малых размеров, а электроны вращаются вокруг ядра на некотором расстоянии.
-
/10
Вопрос 1 из 10
В модели атома Томсона …
- атом представляет собой простую неделимую частицу
- атом представляет собой положительно заряженный шар, внутри которого находятся электроны
- атом состоит из электронов
- атом имеет отрицательный заряд
Что же получилось в опыте Резерфорда?
Исходя из модели атома Дж. Дж. Томсона, Резерфорд предполагал, что сплошные области положительного заряда, заполняющие весь объем золотых атомов, будут отклонять или сгибать траектории всех альфа-частиц, когда они проходят через фольгу.
Однако подавляющее большинство альфа-частиц прошло прямо через золотую фольгу, как будто ее и не было. Казалось, они проходят через пустое пространство. Лишь немногие из них отклоняются от прямого пути, как и предполагалось вначале. Ниже приведен график зависимости количества частиц, рассеянных в соответствующем направлении, от угла рассеяния.
![]()
Удивительно, но крошечный процент частиц возвращался от фольги, как баскетбольный мяч отскакивает от щита. Резерфорд понял, что эти отклонения были результатом прямого столкновения между альфа-частицами и положительно заряженными компонентами атома.
От Резерфорда к Нильсу Бору
Следующий крупный шаг вперед в атомной истории произошел в 1913 году, когда датский ученый Нильс Бор опубликовал описание более детальной модели атома. Она определяла более четко места, где могут находиться электроны. Хотя позже ученые будут развивать и более изысканные атомные конструкции, но планетарная модель атома Бора была в основном правильной, и многое из нее принимается до сих пор. Она имела множество полезных приложений, например с ее помощью объясняют свойства различных химических элементов, характер спектра их излучений и строение атома. Планетарная модель и модель Бора явились важнейшими вехами, обозначившими появление нового направления в физике – физики микромира. Бор получил Нобелевскую премию 1922 по физике за его вклад в наше понимание структуры атома.
Опыты Резерфорда
Масса электронов в несколько тысяч раз меньше массы атомов. Так как атом в целом нейтрален, то, следовательно, основная масса атома приходится на его положительно заряженную часть.
Для экспериментального исследования распределения положительного заряда, а значит, и массы внутри атома Резерфорд предложил в 1906 г. применить зондирование атома с помощью α-частиц. Эти частицы возникают при распаде радия и некоторых других элементов. Их масса примерно в 8000 раз больше массы электрона, а положительный заряд равен по модулю удвоенному заряду электрона. Это не что иное, как полностью ионизированные атомы гелия. Скорость α-частиц очень велика: она составляет 1/15 скорости света.
Этими частицами Резерфорд бомбардировал атомы тяжелых элементов. Электроны вследствие своей малой массы не могут заметно изменить траекторию α-частицы, подобно тому как камушек в несколько десятков граммов при столкновении с автомобилем не в состоянии заметно изменить его скорость. Рассеяние (изменение направления движения) α-частиц может вызвать только положительно заряженная часть атома. Таким образом, по рассеянию α-частиц можно определить характер распределения положительного заряда и массы внутри атома. Схема опытов Резерфорда показана на рисунке 1.
Радиоактивный препарат, например радий, помещался внутри свинцового цилиндра 1, вдоль которого был высверлен узкий канал. Пучок α-частиц из канала падал на тонкую фольгу 2 из исследуемого материала (золото, медь и пр.). После рассеяния α-частицы попадали на полупрозрачный экран 3, покрытый сульфидом цинка. Столкновение каждой частицы с экраном сопровождалось вспышкой света (сцинтилляцией), которую можно было наблюдать в микроскоп 4. Весь прибор размещался в сосуде, из которого был откачан воздух.
При хорошем вакууме внутри прибора в отсутствие фольги на экране возникал светлый кружок, состоящий из сцинтилляций, вызванных тонким пучком α-частиц. Но когда на пути пучка помещали фольгу, α-частицы из-за рассеяния распределялись на экране по кружку большей площади. Модифицируя экспериментальную установку, Резерфорд попытался обнаружить отклонение α-частиц на большие углы. Совершенно неожиданно оказалось, что небольшое число α-частиц (примерно одна из двух тысяч) отклонилось на углы, большие 90°. Позднее Резерфорд признался, что, предложив своим ученикам эксперимент по наблюдению рассеяния α-частиц на большие углы, он сам не верил в положительный результат. «Это почти столь же невероятно, — говорил Резерфорд, — как если бы вы выстрелили 15-дюймовым снарядом в кусок тонкой бумаги, а снаряд возвратился бы к вам и нанес вам удар». В самом деле, предвидеть этот результат на основе модели Томсона было нельзя. При распределении по всему атому положительный заряд не может создать достаточно интенсивное электрическое поле, способное отбросить а-частицу назад. Максимальная сила отталкивания определяется по закону Кулона\[~a(1 + e^2 / 2)\]
где qα — заряд α-частицы; q — положительный заряд атома; r — его радиус; k — коэффициент пропорциональности. Напряженность электрического поля равномерно заряженного шара максимальна на поверхности шара и убывает до нуля по мере приближения к центру. Поэтому, чем меньше радиус r, тем больше сила, отталкивающаяα-частицы.
\(~F = k \dfrac{|q_\alpha| |q|}{r^2}\) , (1)
Определение размеров атомного ядра. Резерфорд понял, что α-частица могла быть отброшена назад лишь в том случае, если положительный заряд атома и его масса сконцентрированы в очень малой области пространства. Так Резерфорд пришел к идее атомного ядра — тела малых размеров, в котором сконцентрированы почти вся масса и весь положительный заряд атома.
На рисунке 2 показаны траектории а-частиц, пролетающих на различных расстояниях от ядра.
Подсчитывая число α-частиц, рассеянных на различные углы, Резерфорд смог оценить размеры ядра. Оказалось, что ядро имеет диаметр порядка 10 -12—10 -13 см (у разных ядер диаметры различны). Размер же самого атома 10 -8 см, т. е. в 10 — 100 тыс. раз превышает размеры ядра. Впоследствии удалось определить и заряд ядра. При условии, что заряд электрона принят за единицу, заряд ядра в точности равен номеру данного химического элемента в периодической системе Д. И. Менделеева.
Проблемы теории
Модель строения атома Резерфорда пришла на смену модели Томпсона. Ядро в ней отсутствовало, атом был сплошным положительным зарядом, нафаршированным отрицательными зарядами. Последние свободно вращались вокруг своей оси.
Изначально Эрнест Резерфорд не связывал величину заряда и атомный номер. Он предполагал, что они пропорциональны. Взаимосвязь между электрическим зарядом и атомным номером вещества установлена Г. Мозли в 1913 году.
У теории есть заметный недостаток: вращающиеся электроны обладают центростремительным ускорением – являются источниками электромагнитных волн. Излучение должно приводить к потере кинетической энергии, вследствие – сближаться с ядром и сталкиваться с ним. Бор выдвинул доработанную модель Резерфорда – электроны вращаются по стационарным орбитам без излучения энергии, а теряют или поглощают её при переходе между орбитами.
Теория и эксперимент
Может ли какой-нибудь эксперимент подтвердить результаты теории? Слово А.Эйнштейну: «Опыт никогда не скажет теории «да», но говорит в лучшем случае «может быть», большей частью — просто «нет». Когда опыт согласуется с теорией, для нее это означает «может быть», когда же противоречит ей, объявляется приговор «нет». Таким образом, суждение о том, сколько и каких экспериментов необходимо, чтобы подтвердить истинность теории, не может быть абсолютно безупречным — чем их больше, тем больше у исследователя степень уверенности, что теория достоверна. Но абсолютной уверенности нет никогда — на определенном этапе разработки проблемы может «подвернуться» факт, экспериментальный результат, противоречащий ей, и, если это не случайность, следует серьезно задуматься: всегда ли верна теория (а иногда и о том, верна ли она вообще).
Несмотря на большое число экспериментов, свидетельствовавших в пользу теории Бора, ряд фактов она объяснить не смогла (например, интенсивность спектральных линий, количественный расчет атома гелия, дублетные линии в спектрах и многое другое). В чем же причина? Очевидно, во внутренней противоречивости теории и в попытках соединить несоединимое — классику и квантовые постулаты, и не только в предельных случаях, а во всей области действия.
В 1926-1927 годах Э.Шрёдингер и В.Гейзенберг, опираясь на теорию Бора и многочисленные экспериментальные и теоретические посылки, заложили фундамент последовательной теории строения атома — квантовой механики. А что же теория Бора? Ряд ее результатов, например правила квантования Бора — Зоммерфельда, стали тем предельным случаем, в котором квантовая механика пересеклась с теорией Бора. Некоторые результаты представляют огромный исторический интерес, а идея дискретности микромира — важнейший отправной пункт дальнейших исследований ученых. Теория Бора, по словам Эйнштейна, была «наивысшей музыкальностью в области мысли». Высокую оценку трудов ученого дал и Резерфорд: «Я рассматриваю труды Бора как величайший триумф человеческой мысли».
В 1922 году Бор получил Нобелевскую премию по физике «За заслуги в изучении строения атома».
Наблюдения
Изучая воздействия на флуоресцентный экран, Резерфорд и его помощники заметили, что:
- Очень высокий процент альфа-частиц прошел через лист без заметных отклонений.
- Некоторые отклонились на довольно крутые углы
- И очень немногие отскочили обратно
![]()
Наблюдения 2 и 3 удивили исследователей и заставили их предположить, что человек, ответственный за рассеяние лучей, должен иметь положительный заряд и что в силу наблюдения номер 1 этот человек был намного меньше, чем у альфа-частиц. .
Сам Резерфорд сказал об этом, что это было «… как если бы вы выпустили 15-дюймовый морской снаряд по листу бумаги, и снаряд отскочил назад и попал в вас». Это определенно нельзя объяснить моделью Томпсона.
Анализируя свои результаты с классической точки зрения, Резерфорд обнаружил существование атомного ядра, где сосредоточен положительный заряд атома, что придает ему нейтральность.
Резерфорд продолжил свои эксперименты по рассеянию. К 1918 году новой мишенью для альфа-частиц были атомы азота.
Таким образом он обнаружил ядра водорода и сразу понял, что единственное место, откуда эти ядра могут появиться, — это сам азот. Как могло случиться, что ядра водорода были частью азота?
Затем Резерфорд предположил, что ядро водорода, элементу, которому уже присвоен атомный номер 1, должно быть фундаментальной частицей. я называю ее протон, Греческое слово для обозначения Первый. Таким образом, открытие атомного ядра и протона принадлежит этому блестящему новозеландцу.
Трубка Крукса
Трубка Крукса была устройством, разработанным британским химиком и метеорологом Уильямом Круксом (1832-1919). Эксперимент, который Крукс провел в 1875 году, заключался в помещении в трубку, наполненную газом низкого давления, двух электродов, один из которых назывался катод а другой позвонил анод.
Установив разность потенциалов между двумя электродами, газ стал светиться цветом, характерным для используемого газа. Этот факт предполагал, что внутри атома существует некая особая организация и, следовательно, он не является неделимым.
Кроме того, это излучение вызывало слабую флуоресценцию на стенке стеклянной трубки перед катодом, вырезая тень крестообразной метки, расположенной внутри трубки.
Это было загадочное излучение, известное как «катодные лучи», которое двигалось по прямой к аноду и было очень энергичным, способным вызывать механические эффекты, и которое отклонялось к положительно заряженной пластине или также через магниты.
Атом больше не неделим
Идеи греческих философов о структуре материи оставались верными в течение сотен лет, пока английский химик и учитель по имени Джон Далтон (1776-1844) не опубликовал результаты своих экспериментов в 1808 году.
Дальтон согласился с тем, что элементы состоят из очень маленьких частиц, называемых атомами. Но он пошел дальше, заявив, что все атомы одного и того же элемента равны, имеют одинаковый размер, одинаковую массу и одинаковые химические свойства, что делает их неизменными во время химической реакции.
Это первая научно обоснованная модель атома. Как и греки, Дальтон продолжал рассматривать атом как неделимый, следовательно, лишенный структуры. Однако гений Далтона привел его к соблюдению одного из великих принципов сохранения физики:
В химических реакциях атомы не создаются и не уничтожаются, они только меняют свое распределение.
И он установил, каким образом химические соединения образуются из «составных атомов» (молекул):
Когда два или более атомов разных элементов объединяются в одно и то же соединение, они всегда делают это в массовых пропорциях. определенный и постоянный.
XIX век был великим веком электричества и магнетизма. Спустя несколько лет после публикаций Дальтона результаты некоторых экспериментов заставили ученых усомниться в неделимости атома.
Опыт Резерфорда: предложение своей модели атома
В своих опытах Резерфорд пропускал пучок альфа-частиц сквозь тонкую золотую фольгу. Золото было выбрано за пластичность, которая позволила создать очень тонкую фольгу, толщиной едва ли не в один слой молекул. За фольгой располагался специальный экран, подсвечивавшийся при бомбардировке попадающими на него альфа частицами. По теории Томсона альфа-частицы должны были беспрепятственно проходить сквозь фольгу, совсем немного отклоняясь в стороны. Однако, оказалось, что часть частиц так и вела себя, а совсем небольшая часть отскакивала назад, как будто ударившись во что-то.
То есть было установлено, что внутри атома существует нечто твердое и небольшое, от чего и отскакивали альфа-частицы. Тогда-то Резерфорд и предложил планетарную модель строения атома. Планетарная модель атома по Резерфорду объясняла результаты проведения как его экспериментов, так и опытов его коллег. До сего дня не предложено лучшей модели, хотя некоторые аспекты этой теории все равно не согласуются с практикой в некоторых очень узких областях науки. Но в основном, планетарная модель атома самая пригодная из всех. В чем же состоит эта модель?
Квантово-механическая модель строения атома
В основу КММ положена квантовая теория атома, согласно которой электрон обладает как свойствами частицы, так и свойствами волны. Другими словами, о местоположении электрона в определенной точке можно судить не точно, а с определенной долей вероятности.
Согласно , электроны в процессе своего движения в атоме формируют электронное облако — модель состояния электрона в атоме.
Вращающийся вокруг ядра электрон, движется в определенной области пространства, являющейся наиболее энергетически выгодной — такая область называется орбиталью.
Энергетическое состояние электрона в атоме описывают квантовыми числами n, l, ml, ms:
| Квантовое число | Символ | Описание | Значения |
| Главное | n | Энергетический уровень орбитали (размер электронного облака) | Положительные целые числа: 1, 2, 3… |
| Орбитальное | l | Энергетический подуровень орбитали (форма электронного облака) | Целые числа от 0 до n-1 |
| Магнитное | ml | Ориентация электронного облака в пространстве | Целые числа от -l до +l |
| Спиновое | ms | Спин электрона (способ движения электрона вокруг своей оси) | +½ и -½ |
Главное квантовое число n
Описывает:
- среднее расстояние от орбитали до ядра;
- энергетическое состояние электрона в атоме.
Чем больше значение n, тем выше энергия электрона и больше размер электронного облака. Если в атоме несколько электронов с одинаковым n, то они образуют электронные облака одинакового размера — электронные оболочки.
Орбитальное квантовое число l (азимутальное)
Описывает форму орбитали, которая зависит от n.
Орбитальное число l может принимать целочисленные значения в диапазоне от 0 до n-1. Например, при n=2: l=0 l=1
| Значение l определяет форму орбитали, а n — ее размер |
Орбитали, имеющие одинаковое n, но разные l называют энергетическими подуровнями и обозначают буквами латинского алфавита:
| l | Энергетический подуровень |
|
0 1 2 3 4 |
s p d f g |
Состояние электрона в атоме для различных главных и орбитальных квантовых чисел принято записывать следующим образом: 2s; 3p; 3d…
Магнитное квантовое число m
Описывает ориентацию орбиталей в пространстве.
Может принимать целочисленные значения в диапазоне от -l до +l (включая 0). Например:
Для l=0 возможно только одно значение: m=0. Это значит, что s-орбиталь имеет только одну пространственную ориентацию.
Для l=1: m=-1;0;+1 — p-орбиталь имеет три пространственные ориентации.
Для l=2: m=-2;-1;0;+1;+2 — d-орбиталь имеет пять пространственных ориентаций.
Спиновое квантовое число ms
Описывает направление вращения электрона в магнитном поле — по часовой стрелке или против. На каждой орбитали может находиться только два электрона: один со спином +½ другой -½.
Квантовые числа для первых трех энергетических уровней:
| n | l | Орбиталь | m | ms |
| 1 | 1s | +½ -½ | ||
| 2 | 2s | +½ -½ | ||
| 2 | 1 | 2p |
-1 0 +1 |
+½ -½ +½ -½ +½ -½ |
| 3 | 3s | +½ -½ | ||
| 3 | 1 | 3p |
-1 0 +1 |
+½ -½ +½ -½ +½ -½ |
| 3 | 2 | 3d |
-2 -1 0 +1 +2 |
+½ -½ +½ -½ +½ -½ +½ -½ +½ -½ |
На первом уровне (n=1) есть только s-орбиталь, на которой может находиться только 2 электрона со спинами +1/2 и -1/2. Это справедливо для s-орбитали любого уровня: 1s; 2s; 3s…
На втором энергетическом уровне (n=2) есть уже две орбитали s; p. На третьем (n=3) — три орбитали: s, p, d. и т.д. С каждым новым энергетическим уровнем добавляется новая орбиталь.
Для 2p-орбитали существует три пространственных ориентации (формы облака), на каждой из которых может находиться по два электрона. Т.е. на втором энергетическом может находиться не более 6 p-электронов.
Для 3d — максимум 10 d-электронов и пять форм облаков.
Главные энергетические уровни отличаются энергией. Чем выше уровень — тем выше энергия. С другой стороны, различные орбитали одного и того же уровня также обладают разной энергией:
Энергия электронов на орбитали 2p выше, чем на 2s
Энергия электронов на орбитали 3p выше, чем на 3s
Энергия электронов на орбитали 3d выше, чем на 3s
Энергия электронов на орбитали 3d выше, чем на 3p
Что же касается электронов «внутри орбиталей», то их энергии одинаковы (так у всех десяти электронов 3d-орбитали энергии одинаковы).
См. далее: Электронная структура атомов
Что такое модель Бора
Модель Бора является модификацией модели Резерфорда. Эта модель была предложена на основе линейчатых спектров атома водорода. Эта модель предполагала, что электроны всегда движутся в определенных оболочках или орбитах вокруг ядра. Модель Бора также указала, что эти оболочки имеют разные энергии и имеют сферическую форму.
Кроме того, модель Бора объяснила, что электроны на одной орбите могут перемещаться на другую орбиту, либо поглощая энергию, либо выделяя энергию.
Рисунок 2: Структура атома в соответствии с моделью Бора
Спектры линий атома водорода имели много дискретных линий. Чтобы объяснить этот спектр, Бор предложил следующее.
- Электроны движутся вокруг ядра в определенных оболочках или
- Эти оболочки имеют дискретные уровни энергии.
- Энергия орбиты связана с размером орбиты. Самая маленькая орбита имеет самую низкую энергию.
- Электроны могут перемещаться с одного энергетического уровня на другой.
Хотя эта модель идеально соответствует атомной структуре атома водорода, при применении этой модели к другим элементам были определенные ограничения. Одним из таких ограничений является невозможность объяснить эффект Зеемана и эффект Штарка, наблюдаемый в линейных спектрах.
Постулаты модели атома Резерфорда
Новая модель сильно отличалась от Томпсона. Это были его постулаты:
- Атом содержит положительно заряженное ядро, которое, несмотря на очень маленькие размеры, содержит почти всю массу атома.
- Электроны вращаются вокруг ядра атома на больших расстояниях по круговым или эллиптическим орбитам.
- Суммарный заряд атома равен нулю, поскольку заряды электронов компенсируют положительный заряд, присутствующий в ядре.
Расчеты Резерфорда указывают на ядро сферической формы и радиусом всего 10-15 м, причем значение радиуса атома примерно в 100000 раз больше, так как ядра расположены сравнительно далеко друг от друга: порядка 10-10 м.
![]()
Это объясняет, почему большая часть альфа-частиц прошла через лист плавно или имела лишь очень небольшой прогиб.
В масштабе обычных объектов атом Резерфорда будет состоять из ядра размером с бейсбольный мяч, а радиус атома будет около 8 км. Следовательно, атом можно рассматривать почти все как пустое пространство.
Благодаря сходству с миниатюрной солнечной системой, она стала известна как «планетарная модель атома». Сила электростатического притяжения между ядром и электронами будет аналогична гравитационному притяжению между Солнцем и планетами.
Принцип соответствия
Отрицая классическую электродинамику, Бор тем не менее все время пытается найти связь между новой и старой теориями и в 1912 году формулирует свой знаменитый принцип соответствия. Согласно этому принципу, физическая теория, явившаяся обобщением и развитием некоторой классической теории, в ряде предельных случаев должна давать результаты, совпадающие с классическими.
В боровской теории атома это следует понимать так: при больших квантовых числах п выводы теории должны соответствовать классическим представлениям. Для атома водорода, например, при больших квантовых числах «расстояния» между соседними энергетическими уровнями оказываются очень малыми (рис. 2), т.е. уровни становятся квазинепрерывными — это и есть отброшенные классические представления. В работе «О спектре водорода» Бор с помощью этого принципа вычисляет постоянную Ридберга. Попробуйте самостоятельно воспроизвести ход его мыслей.
Рис. 2
Модель Томсона
Правильное представление о строение атомов пришло к учёным-физикам не сразу. Английский физик Дж. Дж. Томпсон, который ранее открыл электрон, сформировал первую модель атома. Он предположил, что положительный заряд атома занимает весь объём атома и распределён в этом объёме с постоянной плотностью.
Например, атом водорода (простейшая частица вещества) в представлении Томпсона – это положительно заряженный шар радиусом около 10-8 см с электронами внутри. Более сложные модели атомов выглядят как положительно заряженный шар, внутри которого находится несколько электронов.
Такое представление об атоме напоминает «пудинг с изюмом». «Кекс» – это атом, а «изюминки» – электроны:
![]()
Представленная модель атома совершенно не соответствовала уже известным в то время свойствам атома (например, устойчивости).
Состояние устойчивости система электрических зарядов обретёт лишь при действии электрических сил. Томпсону это было понятно, поэтому он предположил о движении электронов в атоме по замкнутым траекториям.
Позже, в XIX веке, английский физик С. Ирншоу сформулировал и доказал теорему, которая гласила, что система электрических зарядов не может находиться в состоянии устойчивого равновесия лишь под действием электростатических сил.



![§ 1. как устроены атомы? атом водорода [1981 поляков а.м. - разгаданный полупроводник]](http://rosspectr.ru/wp-content/uploads/9/1/2/9123e12bb88d9c7d8a5aad52d3272b97.jpeg)