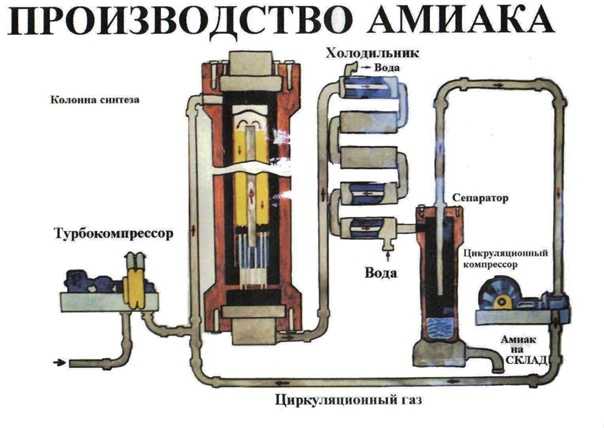
Годовое производство
В XXI — м веке, производство синтетического аммиака, потребляющего от 3 до 5% от мирового производства природного газа (между 1 и 2% производства энергии в мире).
Мировое производство синтетического аммиака
| Год | Производство (млн тонн) | Средняя цена за тонну в США ( долл. США ) |
|---|---|---|
| 1994 г. | 92 | 211 |
| 1995 г. | 96 | 230 |
| 1996 г. | 96 | 225 |
| 1997 г. | 96 | 192 |
| 1998 г. | 106 | 121 |
| 1999 г. | 101 | 110 |
| 2000 г. | 109 | 169 |
| 2001 г. | 105 | 150 |
| 2002 г. | 109 | 137 |
| 2003 г. | 108 | 240 |
| 2004 г. | 117 | 274 |
| 2005 г. | 115 | 295 |
| 2006 г. | 124 | 201 |
| 2007 г. | 125 | 200 |
| 2008 г. | 136 | 500 |
| 2009 г. | 133 | 250 |
| 2010 г. | 131 | 390 |
| 2011 г. | 136 | 520 |
| 2012 г. | 137 | 575 |
По словам Смила, в 2000 или 2001 году годовое производство аммиака составило бы около 130 миллионов тонн, из которых 4/5 были бы переработаны в азотные удобрения. По словам Modak, в 2002 году процесс Haber-Bosch будет обеспечивать производство 130 миллионов тонн азота для удобрений в год, в основном в форме сульфата аммония до фосфата аммония ((NH 4 ) 3 PO 4 ), нитрата аммония и мочевины . По словам Лоуренса, в 2002 году было израсходовано 90 миллионов тонн азотных удобрений, изготовленных из синтетического аммиака.
По словам Смила, производство аммиака и серной кислоты было двумя крупнейшими по массе в конце 1990-х годов. По данным Modak, производство аммиака было шестым по массе в 2002 году.
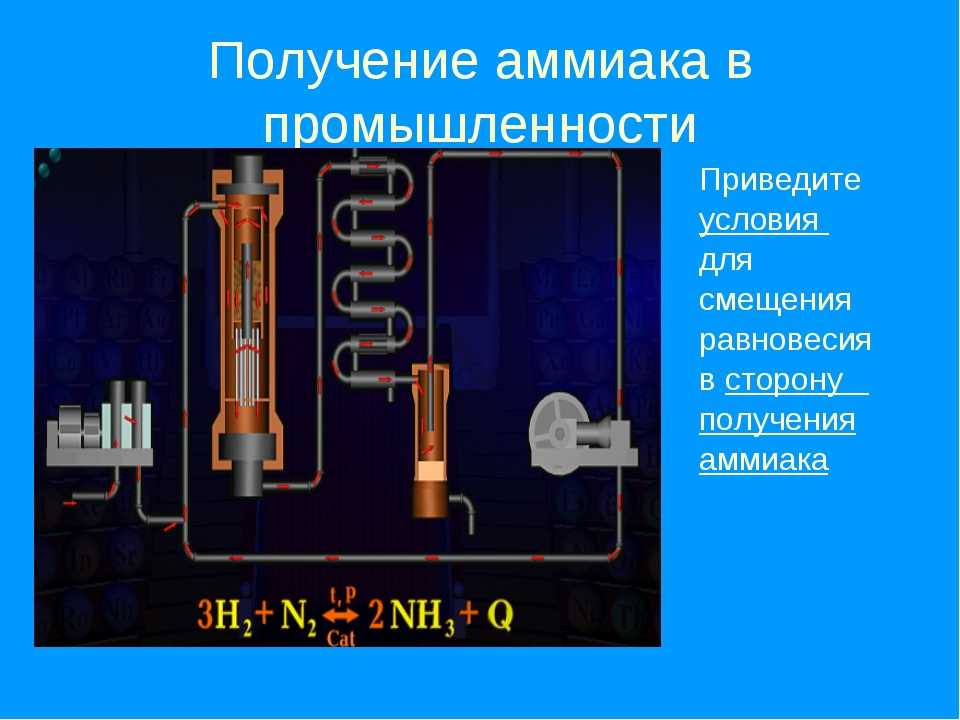
Получение
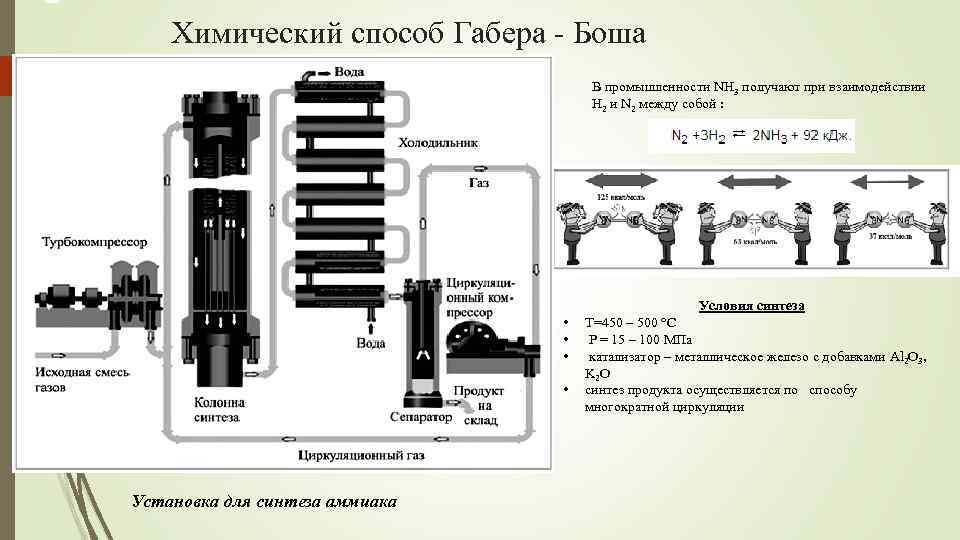
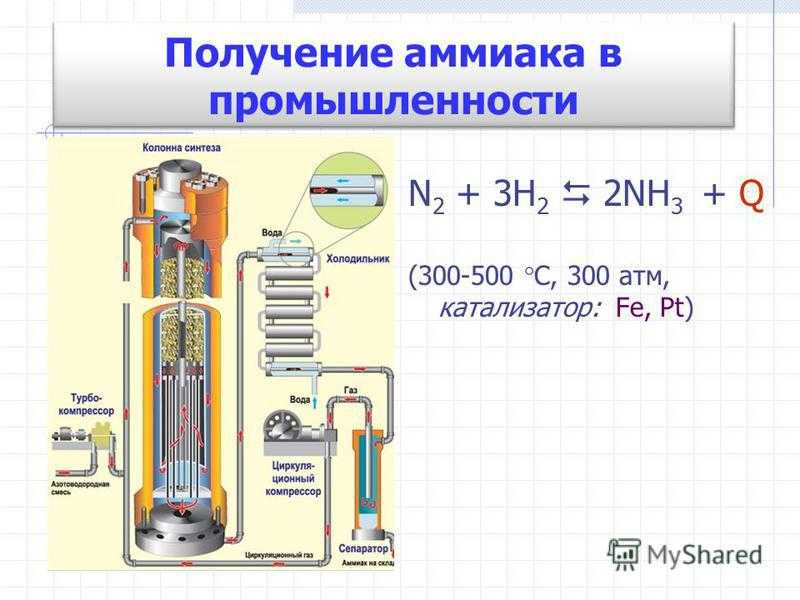
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
-
- N2 + 3H2 ⇄ 2NH3 + 91,84 кДж.
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода).
Реакция происходит с выделением тепла и понижением объёма. Следовательно, исходя из принципа Ле-Шателье, реакцию следует проводить при возможно низких температурах и при высоких давлениях — тогда равновесие будет смещено вправо. Однако скорость реакции при низких температурах ничтожно мала, а при высоких увеличивается скорость обратной реакции. Проведение реакции при очень высоких давлениях требует создания специального, выдерживающего высокое давление оборудования, а значит, и больших капиталовложений. Кроме того, равновесие реакции даже при 700 °C устанавливается слишком медленно для практического её использования.
Выход аммиака (в объёмных процентах) за один проход катализатора при различных температурах и давлении имеет следующие значения:
Жидкий аммиак
Жидкий аммиак, хотя и в незначительной степени, диссоциирует на ионы (автопротолиз), в чём проявляется его сходство с водой:
-
- 2NH3 ⟶ NH4+ + NH2−.
Константа самоионизации жидкого аммиака при −50 °C составляет примерно 10−33 (моль/л)².
Жидкий аммиак, как и вода, является сильным ионизирующим растворителем, в котором растворяется ряд активных металлов: щелочные, щёлочноземельные, Mg, Al, а также Eu и Yb. В отличие от воды с жидким аммиаком данные металлы не реагируют, а именно растворяются и могут быть выделены в исходном виде при испарении растворителя. Растворимость щелочных металлов в жидком NH3 составляет несколько десятков процентов. В жидком аммиаке NH3 также растворяются некоторые интерметаллиды, содержащие щелочные металлы, например, Na4Pb9.
Разбавленные растворы металлов в жидком аммиаке окрашены в синий цвет, концентрированные растворы имеют металлический блеск и похожи на бронзу. При испарении аммиака щелочные металлы выделяются в чистом виде, а щелочноземельные — в виде комплексов с аммиаком [Э(NH3)6], обладающих металлической проводимостью. При слабом нагревании эти комплексы разлагаются на металл и NH3.
Растворённый в NH3 металл постепенно реагирует с образованием амида:
-
- 2Na + 2NH3 ⟶ 2NaNH2 + H2 .
Получающиеся в результате реакции с аммиаком амиды металлов содержат отрицательный ион NH2−, который также образуется при самоионизации аммиака. Таким образом, амиды металлов являются аналогами гидроксидов. Скорость реакции возрастает при переходе от Li к Cs. Реакция значительно ускоряется в присутствии даже небольших примесей H2O.
Металлоаммиачные растворы обладают металлической проводимостью, в них происходит распад атомов металла на положительные ионы и сольватированные электроны, окружённые молекулами NH3. Металлоаммиачные растворы, в которых содержатся свободные электроны, являются сильнейшими восстановителями.
Процесс Габера-Боша спас мир от голода
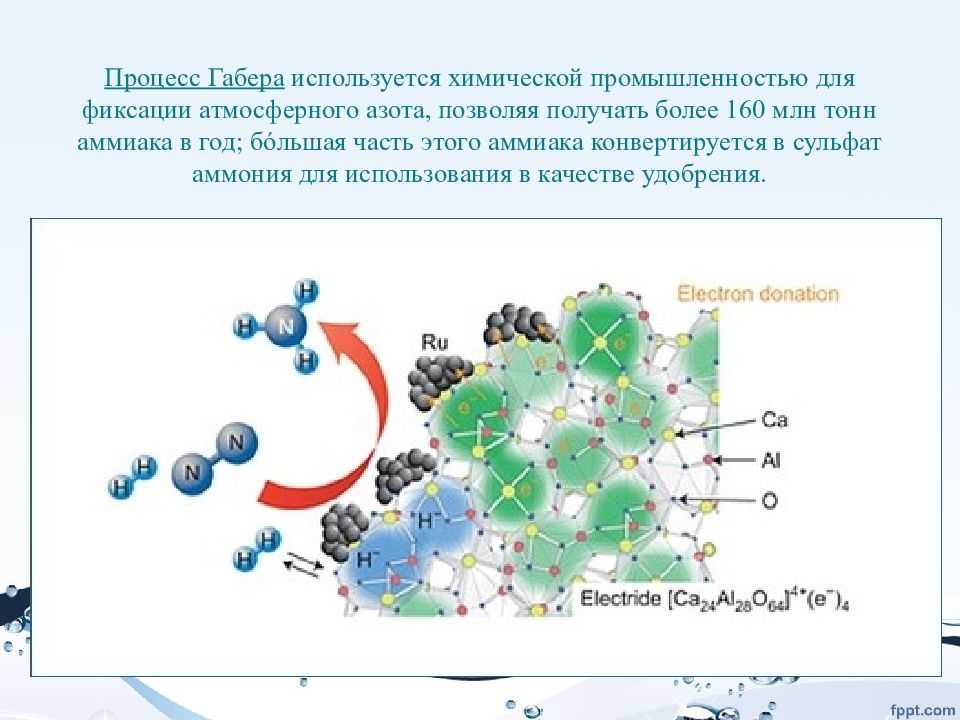
Азот является четвертым по распространенности химическим элементом в нашем организме. Однако знаете ли вы, что половина всех атомов азота внутри нашего тела искусственно синтезирована с использованием процесса Габера-Боша?
Процесс Габера-Боша — это химическая реакция превращения атмосферного азота в аммиак. Фриц Габер изобрел химический процесс, а Карл Бош расширил его до промышленного производства аммиака.
Азот является наиболее важным питательным веществом для растений, поэтому аммиак в основном используется в качестве удобрения.
Две трети ежегодного мирового производства продуктов питания используют аммиак из процесса Габера-Боша.
Природно связанный азот
Селитра — природный минерал, содержащий азот в активной, или связанной, форме. До изобретения процесса Габера другим значимым источником получения реакционноспособного азота было перуанское гуано — помет морских птиц, гнездившихся вдоль побережья Перу. В конце XIX века Европа ввозила и селитру, и гуано как удобрения. Есть и другие пути связывания азота. Молнии превращают небольшие количества азота воздуха в аммиак. Первые процессы получения аммиака симулировали это явление — реакционную смесь подвергали действию электрических разрядов, но этот метод оказался слишком дорогим. Некоторые бактерии, обитающие в клубеньках зернобобовых растений — клевера, гороха, фасоли, — тоже умеют связывать азот. Поэтому фермеры часто практикуют севооборот — чтобы питательные вещества, усвоенные из почвы, восстанавливались и делали почву плодороднее для следующих посевов. Посев клевера выдает почвам «азотный кредит», то есть можно на следующий год вносить меньше удобрений.
Поделиться ссылкой
Происхождение названия
Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрёстке караванных путей. В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали минерал нашатырь (NH4Cl), который при нагревании испаряет аммиак.
Гидразин или диамид, NH2-NH2.
Гидразин (из очень важных примеры водородной связи ) представляет собой гидрид азота, который можно получить, как описано ниже:
Молекула гидразина
Кредит изображения:
Метод Рашига.Очень крепкий (водный раствор) раствор аммиака нагревают (почти кипятят) вместе с гипохлоритом (должен присутствовать даже клей в небольшом количестве)Реакции клея в среде обитания с образованием NHCl2 и NC3, возможно, путем удаления хэви-метал ионы, катализирующие эти реакции. Реакция протекает в две стадии:
Степень окисления атомов азота в молекуле гидразинаравно -2, поэтому приведенное выше реакции представляют собой окисление аммиака.
В процессе перегонки (фракционной) полученная реакционная смесь содержит гидразингидрат. Полученный раствор позже охлаждают и заставляют реагировать с серной кислотой (которая считается труднорастворимой) и выделяют в виде кристаллов осадка.
Безводный гидразин может быть получен обработкой сульфата гидразина жидким аммиаком, когдасульфат аммония осаждается практически количественно.
Сульфат аммония отфильтровывают, избыток аммиака удаляют.дали испариться, оставив безводный гидразин.
За счет уменьшения оксида азота.Мы можем получить гидразин по реакции сульфита калия (который является насыщенным — вместе с оксидом азота и амальгамой натрия.
Свойства.
Физический.Гидразин по своей природе бесцветен, его температура кипения составляет 386 К (также считается, что он смешивается с водой). Также замечено, что он растворим в спирте
Еще одна особенность в том, что он впитывает влагу (гигроскопичен); поэтому при обращении с ним следует соблюдать осторожность
Если оставить контейнер открытым, он может загрязнить вещество. Раствор гидразина в воде имеет слабощелочную реакцию. Он растворяет серу, селен, фосфор и мышьяк.
Поставщик
Образование гидрата. Он хорошо растворяется в воде, из которой можно получить твердый гидрат N2H4.H20, но нельзя обезвоживать.Разложение. При нагревании гидразин разлагается на аммиак и азот.
Основная природа. Гидразин представляет собой слабое двухосновное кислотное основание и может образовывать соли с одним или двумя эквивалентами кислоты.
Например, соляная кислота дает две соли, а именно монохлорид гидразина NH2. NH3Cl и хлорид гидразина NH3Cl. NH3Cl. Обычны соединения только первого типа. Эти основные свойства могут быть связаны с наличием неподеленной пары на каждом атоме азота.
Молекула гидразина имеет несимметричную структуру, в которой группы NH3 не вращаются свободно. Это происходит из-за тенденции неподеленных электронных пар удаляться как можно дальше друг от друга.
ПользыГидразин используется в качестве Восстановитель.Гидразин NH2NH2 и его производное фенилгидразин C6H5NHNH2 используются в качестве реагентов в органической химии.Он используется как топливо для ракет.
Узнайте больше о: Тройной Бонд ЭкзаПримеры: Подробная информация И факты
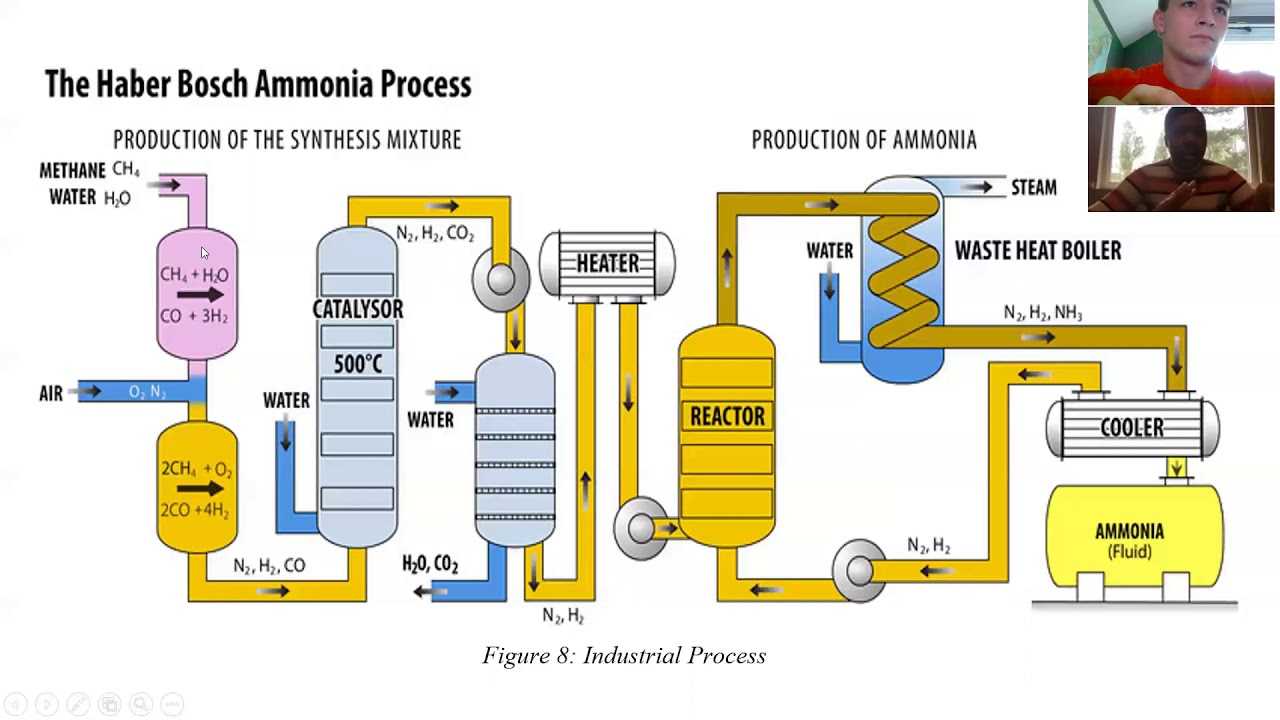
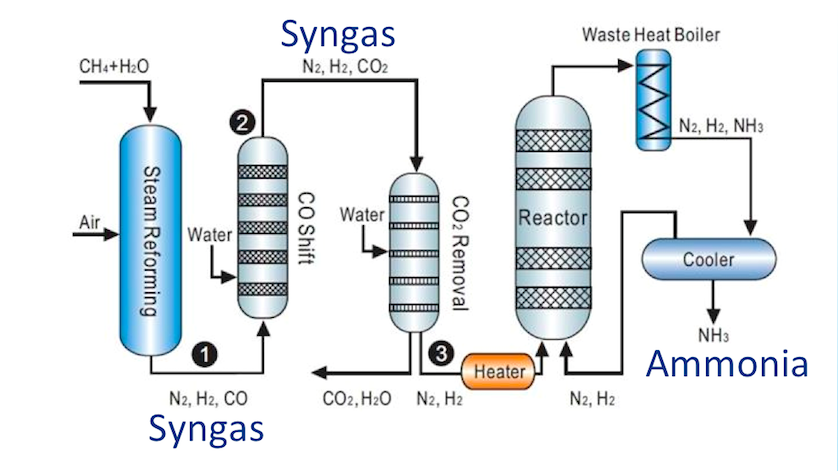
Процесс — габер
Процесс Габера проводят в высокопрочном реакционном сосуде под давлением в несколько сотен атмосфер в присутствии катализатора и при температуре в несколько сотен градусов Цельсия. В таких условиях газообразные азот и водород реагируют друг с другом, образуя аммиак. Но в процессе реакции N2 и Н2 расходуются не полностью.
Подобно процессу Габера, этот процесс был разработан в Германии накануне первой мировой войны.
При всех достоинствах процесса Габера — Боша он выглядит несовершенным и громоздким по сравнению с природным.
Получение исходных веществ для процесса Габера основывается на двух важных технических процессах.
Газообразный аммиак, получаемый в процессе Габера, превращают в жидкость, охлаждая его ниже — 33 С.
В промышленных условиях аммиак синтезируют при помощи процесса Габера.
Принцип Ле Шателье очень наглядно иллюстрируется зависимостью выхода аммиака в процессе Габера от температуры и давления. Равновесная реакция экзотермична в прямом направлении и протекает с уменьшением числа молекул в газовой фазе. Следовательно, наибольший выход аммиака может быть получен при низких температурах и высоких давлениях.
Таким образом, наиболее выгодными условиями проведения синтеза аммиака в процессе Габера являются температура 450 С и давление 250 атм.
Аммиак получается синтетически взаимодействием азота и водорода в присутствии катализатора [ процесс Габера ( Haber), процесс Клода ( Claud) ] и при действии водяных паров на цианамид кальция CaCNa, получающийся из карбида кальция GaCs и № при высокой температуре. Аммиак получается также в виде побочного продукта; при коксовании угля.
Аммиак получается синтетически взаимодействием азота и водорода в присутствии катализатора [ процесс Габера ( Haber), процесс Клода ( Claud) ] и при действии водяных паров на цианамид кальция СаС №, получающийся из карбида кальция ОаС и № при высокой температуре. Аммиак получается также в виде побочного продукта; при коксовании угля.
В дальнейшем мы рассмотрим важность выбора наиболее благоприятных условий для проведения процессов Габера ( разд. Катализаторы не меняют положения равновесия ( разд.
. Связанный азот, получаемый промышленным способом, главным образом, при помощи процесса Габера, в настоящее время составляет более 30 % всего имеющегося на нашей планете связанного азота.
Связанный азот, получаемый промышленным способом, главным образом, при помощи процесса Габера, в настоящее время составляет более 30 % всего имеющегося на нашей планете связанного азота.
Эта реакция представляет значительный интерес, так как она послужила основой для разработки процесса Габера, применяемого в промышленном синтезе аммиака. При низких температурах преобладает прямая реакция, так как процесс эк-зотермичен; протеканию реакции благоприятствует также повышение давления, так как в результате реакции происходит уменьшение объема газа. На практике процесс проводится приблизительно при 500 С и давлении от 100 до 1000 атм. Высокая температура необходима для повышения скорости реакции.
Азот, содержащийся в смешанном газе, совершенно необходим для синтеза аммиака в процессе Габера.
Процесс Клода характеризуется работой под давлением 900 — 1000 ат, против 200 — 250 ат, применяемых в процессе Габера. С и давлении 1000 ат, может находиться 57 5 % аммиака. На практике при объемной скорости 100 000 И при температурах от 500 до 650 С концентрация аммиака достигает 25 %, что соответствует превращению в аммиак 40 % поступающей азото-водородной смеси при прохождении через одну колонну синтеза. Выход аммиака на 1 кг катализатора в час составляет около 6 кг, против 0 3 до 0 4 кг, 1 полулаемых в процессе Габера. Так как при образовании 1 моля аммиака выделяется около 13000 кал, то очевидно, что поддержание уровня температуры сводится к проблеме удалени тепла, а не к его сохранению.
Как работает процесс Габера-Боша
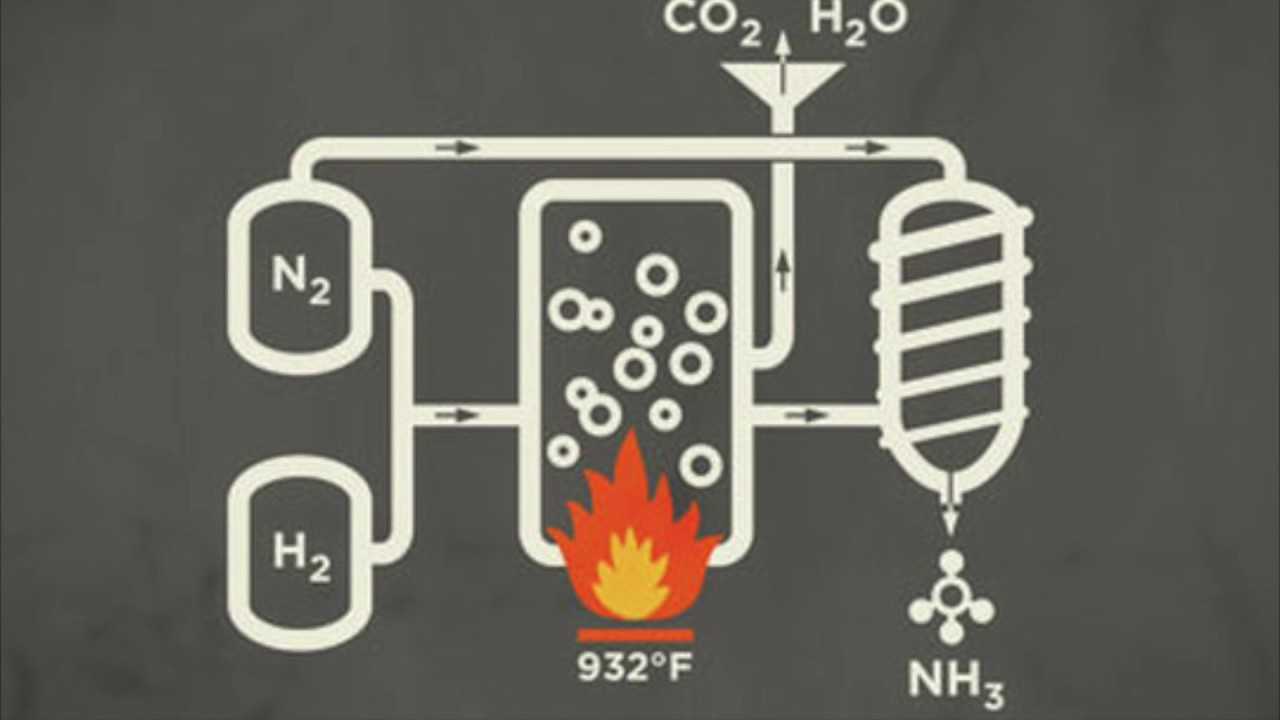
Этот процесс работает сегодня во многом так же, как и первоначально, с использованием чрезвычайно высокого давления для принуждения химическая реакция. Он работает путем связывания азота из воздуха с водородом из природного газа для производства аммиака (диаграмма). В процессе должно использоваться высокое давление, потому что молекулы азота удерживаются вместе прочными тройными связями. В процессе Хабера-Боша используется катализатор или контейнер из железа или рутения с внутренней температурой более 800 F (426 C) и давлением около 200 атмосфер для объединения азота и водорода (Rae-Dupree, 2011). Затем элементы перемещаются из катализатора в промышленные реакторы, где элементы в конечном итоге превращаются в жидкий аммиак (Rae-Dupree, 2011). Затем жидкий аммиак используется для создания удобрений.
Сегодня химические удобрения составляют около половины азота, поступающего в мировое сельское хозяйство, и это число выше в в развитых странах.
Лауреат Нобелевской премии Фриц Габер изобрел удобрения, а также стал родоначальником газовой войны.
Что общего между удобрениями, ядовитым газом времен Первой мировой войны и нацистскими газовыми камерами?
Фриц Габер.
Фриц Габер (1868-1934) был немецким лауреатом Нобелевской премии, который изобрел химические реакции для производства искусственных удобрений, которые повысили урожайность и позволили увеличить население Земли до 8 миллиардов в 2020 году.
С другой стороны, его опыт был использован для гибели миллионов людей. Будучи немецким патриотом, Габер использовал свои знания в области химии, чтобы помочь Германии во время Первой мировой войны (1914-1918), работая над производством ядовитых газов и взрывчатых веществ.
АММИАКА
Вхождение.
Следы аммиака встречаются в воздухе вокруг Земли. Он образуется в природе в результате действия гнилостных и аммонифицирующих бактерий на азотистые органические вещества, например, мочу и т. Д.
Гидрирование примеры облигаций аммоний
Кредит изображения: Википедия
Приготовление
Аммиак можно получить следующими способами:
Путем разложения солей аммония едкими щелочами или известью, например
За счет уменьшения нитратов или нитритов цинком и каустической содой.
Нитраты могут быть легко восстановлены щелочами и тонкоизмельченным сплавом Деварда (50 частей Cu, 45 частей Al, 5 частей Zn).
Лабораторное приготовление аммиакаАммиак получают в лаборатории путем нагревания хлорида аммония с гашеной известью (в соотношении 1: 3) в пробирке из твердого стекла. Выделяющийся газ сушится, проходя через башню, заполненную негашеной известью, и собирается путем вытеснения воздуха вниз. Газ, который хорошо растворяется в воде, не может собираться над водой. Однако его можно собрать вместе с ртутью.
Аммиак реагирует с серной кислотой с образованием сульфата аммония, с хлоридом кальция с образованием CaCl₂,8NH₃ и с пентоксидом фосфора с образованием NH₄PO₃.
Следовательно, серную кислоту, хлорид кальция или пятиокись фосфора нельзя использовать для сушки аммиака.
Однако его можно удобно получить в лаборатории путем нагревания некоторого количества щелока с аммиаком.
Однако первый катализатор (тонкодисперсное железо с молибденом в качестве промотора) широко используется.
В Германии использовалось давление 200 атмосфер при 720-770 К, когда выход составлял 15 процентов. Это увеличилось до 40 процентов в процессе французского Клода, в котором давление около 900 атмосфер использовалось при той же температуре.
Загрязненные газы отравляют катализатор; поэтому используемые водород и азот должны быть очень чистыми.
Смесь азота и водорода, необходимая для этой цели, также производится путем пропускания смеси водяного газа (CO + H2), генераторного газа (N2 + CO) и пара над нагретым оксидом железа (катализатор), смешанным с Cr2O3 (промотор) при 720 770 K. Окись углерода окисляется паром до двуокиси углерода, которую удаляют промывкой газа водой при давлении 25 атмосфер.
Наличие избытка пара снижает равновесная концентрация угарного газа до минимума.
Удаление каталитических ядов.Присутствие двуокиси углерода, окиси углерода и следов соединений серы (H2S) отравляет катализатор
Поэтому удаление этих каталитических ядов очень важно. Углекислый газ удаляют, как указано выше, растворением в воде под давлением 10-50 атмосфер
Окись углерода удаляется путем промывки газа аммиачным раствором формиата или ацетата одновалентной меди, тогда как сероводород удаляется путем абсорбции в растворе гидроксида калия под давлением.
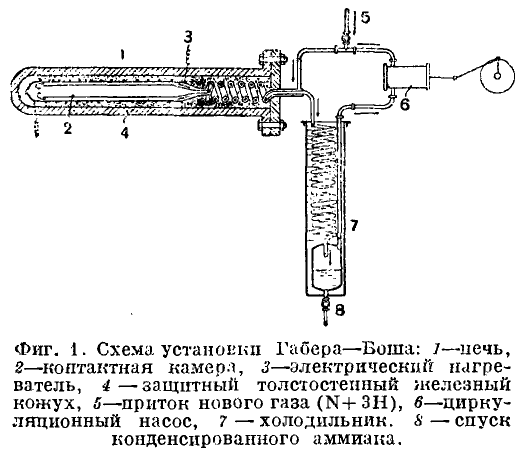
Процесс Габера — для производства аммиака
Изображение предоставлено: Учебник неорганической химии. Султан Чанд и сыновья
Обработать.Схематическое изображение используемого завода. Азот, полученный сжижением воздуха, смешивают с чистым сухим водородом, в 3 раза превышающим его объем, и сжимают до давления 200-350 атмосфер. Сжатая смесь пропускается через катализатор, температура которого поддерживается примерно 725-775 К в камере с электрическим обогревом.
Выходящие газы, содержащие около 10-20% аммиака при температуре 375-475 К, охлаждаются в водоохладителе при сжижении некоторого количества аммиака. Остаточные газы, содержащие 6-7% аммиака, рециркулируют. Больше аммиака можно конденсировать при охлаждении до 253 К, когда остаточные газы содержат только 1.2% аммиака. Альтернативно аммиак можно растворить в воде.
Аммиак хранят в стальных цистернах или сосудах из чугуна, алюминиевого полиэтилена, резины и т. Д. Аммиак транспортируют в стальных баллонах или вагонах-цистернах, предназначенных для выдерживания давления паров аммиака.На сегодняшний день это самый дешевый и самый важный метод производства аммиака. Технологическая схема процесса Габера представлена на рис. 2.
Рис.2 Производство аммиака
Изображение предоставлено: Учебник неорганической химии. Султан Чанд и сыновья
Тесты на аммиак
Имеет характерный резкий запах.Влажная красная лакмусовая бумага становится синей, а влажная бумага с куркумой — коричневой.
Использование аммиака
- В качестве хладагента в ледяных установках.
- При производстве азотной кислоты
Гидразойная кислота, N3H.
Это еще один важный гидрид азота, и в отличие от аммиака и гидразина он имеет кислую природу.Подготовка.
Молекула гидразойной кислоты
Кредит изображения:
Приготовление
Он может быть получен действием азотистая кислота на гидразине или его солях, например, хлорид гидразина.
Свойства
Физический
Азоистоводородная кислота представляет собой бесцветную летучую жидкость с очень неприятным запахом. Он ядовит по своей природе. Он сильно взрывается при ударе или ударе. Это легко растворим в воде и алкоголь. Он кипит при 310 К, а при затвердевании плавится при 186 К.
Поставщик
Снижение
Гидразойная кислота восстанавливается амальгамой натрия или мелкодисперсной платиной до аммиака или гидразина.
Окисление
Окислители, например подкисленный перманганат калия и т.п., окисляют кислоту до азота и воды.
Узнайте больше о: Стереоселективный против Stэреоспецифический: Detailed Выводы и факты
История открытия
Хотя Роберта Бойля и называли «отцом химии», именно он открыл самый известный газовый закон физики. Бойль описал, как давление газа связано с объемом. Этот и еще пара других газовых законов стали первым ключом к тому, как устроена материя на непостижимом пока атомном уровне.
В конце 1670-х годов Роберт Бойль и француз Дени Папен (справа) в лаборатории заполняют стеклянные емкости и другие части аппарата, в том числе и сферический вакуумный насос (сзади справа) — основное звено в открытии Бойля.
Паскаль изучал силы в жидкостях, Гук занимался упругими свойствами твердых тел, а Роберт Бойль вслед за Отто фон Герике занялся газами, или, как говорили тогда, «воздухом». (Не забывайте, что даже в самые древние времена считалось, что элементов природы четыре — воздух, земля, огонь и вода.)
Бойль воспитывался под влиянием Фрэнсиса Бэкона, английского философа, опубликовавшего одно из первых описаний научного метода исследований. (Другие ученые, не говоря уже об аль-Хайсаме и Галилео, уже использовали похожий метод исследований.) Бойль начал с традиционного скептицизма, который составляет в наши дни в науке саму основу, а именно отбросил принимаемые на веру положения алхимии, в основе которой лежали не факты, а религиозные предрассудки.
Воздушная пружина
Будучи родом из богатой ирландской семьи, Бойль и в науке зарекомендовал себя как джентльмен. Он построил лабораторию в своем доме в Лондоне и привлек Роберта Гука для изготовления «пневматической машины» — по сути, вакуумного насоса, подобно насосу Герике.
Первая книга Бойля, опубликованная в 1660 году, имела традиционно описательное название: «New Experiments PhysicoMechanical: Touching the Spring of the Air and their Effects» («Новые физикомеханические эксперименты: пружинящий воздух и другие эффекты») и детально описывала «пневматическую машину».
Бойль также привлек к работе лучшего лондонского мастера стекольных дел, который изготавливал ему необычные стеклянные емкости — без них не состоялась бы даже первая серия опытов Бойля. Кстати, их результаты были опубликованы в 1660 году в статье под названием «Новые физико-механические эксперименты: пружинящий воздух и другие эффекты». Эксперименты показали, что в вакууме звук распространяться не может, а пламя в отсутствие воздуха не горит. Также Бойль доказал, что без воздуха не могут жить не только животные, но и растения.
Бойль много занимался физической природой «воздуха». Например, он показал, что в вакууме перо падает столь же быстро, как и камень. Это наводило на мысль, что воздух содержит материю, хоть и невидимую глазом.
В 1662 году Бойль опубликовал то, что мы теперь знаем как «закон Бойля». Он обнаружил, что давление в сосуде с газом растет при уменьшении объема сосуда, и установил закон роста давления. Выражаясь современными словами, давление газа (P) обратно пропорционально объему (V): P 1/V. Бойль воспользовался этим эмпирическим законом, чтобы доказать свою идею о том, что воздух состоит из «корпускул» — крошечных частиц, хаотично двигающихся во всех направлениях, сталкивающихся друг с другом и со стенками сосуда и создающих таким образом давление.
Закон Бойля утверждает, что давление газа обратно пропорционально его объему. Если вы сжимаете газ до меньшего объема, то его давление возрастает, поскольку молекулы в сосуде чаще сталкиваются с его стенками.
Газовые законы, все формулы и примеры решений
Газовые законы были открыты экспериментально, но все они могут быть получены из уравнения Менделеева-Клапейрона.
Рассмотрим каждый из них.
Закон Бойля-Мариотта (изотермический процесс)
Изотермическим процессомназывают изменение состояния газа, при котором его температура остаётся постоянной.
Для неизменной массы газа при постоянной температуре произведение давления газа на объем есть величина постоянная:
Этот же закон можно переписать в другом виде (для двух состояний идеального газа):
Этот закон следует из уравнения Менделеева – Клапейрона:
Очевидно, что при неизменной массе газа и при постоянной температуре правая часть уравнения остается постоянной величиной.
Графики зависимости параметров газа при постоянной температуре называются изотермами.
Обозначив константу буквой , запишем функциональную зависимость давления от объема при изотермическом процессе:
Видно, что давление газа обратно пропорционально его объему. Графиком обратной пропорциональности, а, следовательно, и графиком изотермы в координатах является гипербола (рис.1, а). На рис.1 б) и в) представлены изотермы в координатах и соответственно.
Рис.1. Графики изотермических процессов в различных координатах
Закон Гей-Люссака (изобарный процесс)
Изобарным процессомназывают изменение состояния газа, при котором его давление остаётся постоянным.
Для неизменной массы газа при постоянном давлении отношение объема газа к температуре есть величина постоянная:
Для двух состояний газа этот закон запишется в виде:
Этот закон также следует из уравнения Менделеева – Клапейрона:
Графики зависимости параметров газа при постоянном давлении называются изобарами.
Рассмотрим два изобарных процесса с давлениями и . В координатах и изобары будут иметь вид прямых линий, перпендикулярных оси (рис.2 а,б).
Определим вид графика в координатах .Обозначив константу буквой , запишем функциональную зависимость объема от температуры при изобарном процессе:
Видно, что при постоянном давлении объем газа прямо пропорционален его температуре. Графиком прямой пропорциональности, а, следовательно, и графиком изобары в координатах является прямая, проходящая через начало координат (рис.2, в). В реальности при достаточно низких температурах все газы превращаются в жидкости, к которым газовые законы уже неприменимы. Поэтому вблизи начала координат изобары на рис.2, в) показаны пунктиром.
Рис.2. Графики изобарных процессов в различных координатах
Закон Шарля (изохорный процесс)
Изохорным процессомназывают изменение состояния газа, при котором его объем остаётся постоянным.
Для неизменной массы газа при постоянном объеме отношение давления газа к его температуре есть величина постоянная:
Для двух состояний газа этот закон запишется в виде:
Этот закон также можно получить из уравнения Менделеева – Клапейрона:
Графики зависимости параметров газа при постоянном давлении называются изохорами.
Рассмотрим два изохорных процесса с объемами и . В координатах и графиками изохор будут прямые, перпендикулярные оси (рис.3 а, б).
Для определения вида графика изохорного процесса в координатах обозначим константу в законе Шарля буквой , получим:
Таким образом, функциональная зависимость давления от температуры при постоянном объеме является прямой пропорциональностью, графиком такой зависимости является прямая, проходящая через начало координат (рис.3, в).
Рис.3. Графики изохорных процессов в различных координатах
Хранение и транспортировка газов
Если нужно перевезти значительное количество газа из одного места в другое, или когда газы необходимо длительно хранить — их помещают в специальные прочные металлические сосуды. Из-за того, что при уменьшении объема увеличивается давление, газ можно закачать в небольшой баллон, но он должен быть очень прочным.
Сосуды, предназначенные для транспортировки газов, выдерживают высокие давления. Поэтому с помощью специальных насосов (компрессоров) туда можно закачать значительные массы газа, которые в обычных условиях занимали бы в сотни раз больший объем.
Поскольку давление газов в баллонах даже при комнатной температуре очень велико, их ни в коем случае нельзя нагревать. Например, держать под прямыми лучами солнца или любым способом пытаться сделать в них отверстие, даже после использования.
Понимать и любить этот мир проще, когда разбираешься в физике. В этом помогут небезразличные и компетентные преподаватели онлайн-школы Skysmart.
Чтобы формулы и задачки ожили и стали более дружелюбными, на уроках мы разбираем примеры из обычной жизни современных подростков. Приходите на бесплатный вводный урок по физике и начните учиться в удовольствие уже завтра!
Вывод
Жизнь Фрица Габера подчеркивает важность этики в науке. Как мы используем новые открытия и как мы можем гарантировать, что они будут использованы во благо?. Например, процесс Габера-Боша позволил немцам производить удобрения, а также взрывчатые вещества
Например, процесс Габера-Боша позволил немцам производить удобрения, а также взрывчатые вещества.
Фриц Габер получил много негативного внимания за то, что он использовал свой гений в военных действиях Германии, особенно в работе с отравляющими газами.
С другой стороны, Оппенгеймер, работавший над созданием атомной бомбы, такой критики не подвергался. Не потому ли, что Габер поддержал сторону, проигравшую войну?
Мой телеграмм канал — https://t.me/War_Hist0ry
Подписывайтесь на канал – это лучший способ поддержать канал!
Поддержите статью лайком, если было интересно.