Понятие о рН (водородном показателе)
Вода — очень слабый электролит: при обычных условиях лишь одна молекула воды из 10 000 000 распадается на ионы:
Это уравнение показывает, что при диссоциации 1 моль молекул воды образуется 1 моль ионов водорода Н+ и 1 моль гидроксид-анионов ОН–. Другими словами: в чистой воде концентрация ионов водорода равна концентрации гидроксид-анионов:
Здесь: — равновесная концентрация ионов водорода, моль/л; — равновесная концентрация гидроксид-анионов, моль/л.
Такой раствор (среда) называется «нейтральный».
Характер среды — кислый, нейтральный — можно оценить количественно при помощи рН («пэ-аш»). Водородный показатель рН равен логарифму концентрации ионов водорода, взятому с обратным знаком*:
Поэтому в случае чистой воды рН = 7.
Раствор, у которого рН = 7, называется нейтральным.
Если к чистой воде добавили кислоту, то увеличили концентрацию ионов водорода. Теперь эта концентрация составит, например 10–6 моль/л или 10–2 моль/л.
Такая среда (раствор) называется «кислая», или «кислотная». Причём в первом случае (рН = 6) среда считается слабокислой, а во втором (рН = 2) — сильнокислой, т. е. в любом случае рН < 7. Значение рН можно измерять и с большей точностью (например, рН = 5,36).
pН < 7, среда кислая.
При добавлении щёлочи увеличивается концентрация ионов ОН–, и одновременно уменьшается концентрация ионов Н+. Дело в том, что для любого водного раствора
Поэтому, если концентрация ионов ОН– составит 10–3, то = 10–11, т. е.
рН > 7, среда щелочная.
Определить реакцию среды конкретного раствора можно при помощи индикаторов.
Индикаторы — это вещества, которые изменяют свой цвет в присутствии избытка ионов Н+ или ОН–.
Ионы Н+ или ОН– действуют на молекулу индикатора, и индикатор меняет цвет по-разному в зависимости от реакции среды и вида самого индикатора (табл. 7).
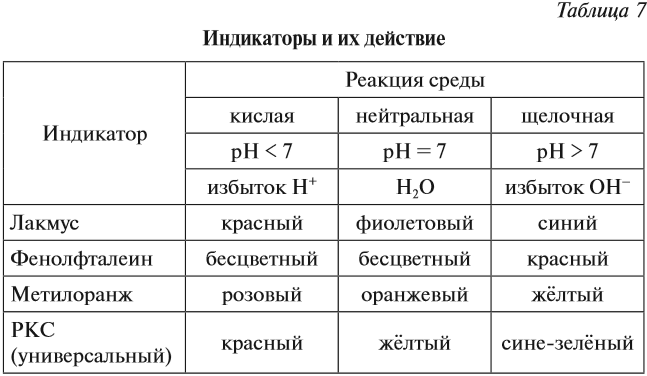
Задание 6.10. Какую окраску будет иметь индикатор лакмус, если:
- рН < 7;
- = 10–4 моль/л;
- в растворе есть избыток ОН–;
- рН = 7;
- = 10–8 моль/л;
- в растворе есть НNО3;
- = 0,1 моль/л.
Окраска индикаторов изменяется в растворах, которые содержат избыток одного из этих ионов. Ионы Н+ или ОН– могут образовываться в ходе диссоциации некоторых соединений.
Вопрос. Какие вещества при диссоциации образуют ионы Н+ или ОН–?
Эти ионы могут образовываться при диссоциации растворимых кислот, оснований, некоторых кислых и основных солей. Например, дигидрофосфат натрия образует при диссоциации ионы водорода, а гидрофосфат натрия — нет. Дело в том, что кислые соли могут диссоциировать ступенчато, если полученный на первой стадии анион соответствует сильному электролиту:
остаток слабого электролита → диссоциация не идёт;
остаток сильного электролита → диссоциация идёт:
Образуются ионы Н+, возникает кислая среда.
Кроме того, ионы Н+ или ОН– могут образовываться в ходе взаимодействия некоторых веществ с водой. Например, с водой могут взаимодействовать активные металлы, кислотные и основные оксиды.
Задание 6.11. Какую окраску будет иметь индикатор лакмус, если в воде растворить: кальций, оксид лития, оксид серы (IV)?

Опыт №10 «Рисование солью и сахаром»
1.Оборудование: Соль, сахара, акварельные краски, кисти, вода, раскраска.

2. Оборудование: Соль, сахар, цветной картон, клей ПВА.

3. Оборудование: Окрашенные соль и сахар, клей ПВА, аппликация.

4. Оборудование: Окрашенные соль и сахар, клей ПВА, белый картон.

1.Раскрашиваем раскраску акварельными красками, пока краска не высохла, посыпаем солью и сахаром. Через некоторое время убираем соль и сахар с рисунка. Получаем красивые разводы в местах, где была соль и сахар.

2.Берем цветной картон, рисуем клеем ПВА любое изображение. Пока клей не высох, посыплем его солью или сахаром. После высыхание стряхиваем остатки соли или сахара.

3. Берем заранее подготовленную аппликацию. Покрываем клеем ПВА рисунок, посыпаем сверху клея цветным сахаром или солью. После высыхание стряхиваем остатки соли или сахара.

4. Берем белый картон, рисуем клеем ПВА любое изображение. Пока клей не высох, посыплем его цветной солью или сахаром. После высыхание стряхиваем остатки соли или сахара.
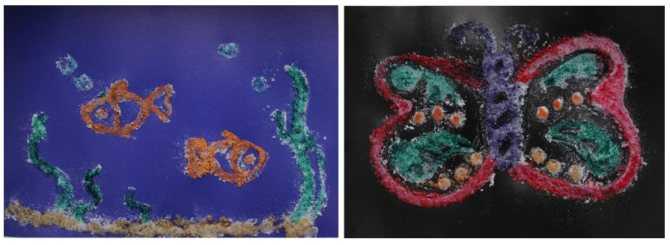
Вывод: Соль и сахар можно использовать для создания творческих работ. Стимулировать интерес к созданию творческих работ с использованием соли и сахара как материала.
Приготовление концентрированного усилителя вкуса
1. В сироповарочный котел наливают чистую питьевую воду в количестве 60-65 частей. Количество воды взято с учетом выпарки при приготовлении и получения в итоге примерно 100 частей готового концентрированного усилителя вкуса.
2. Нагревают воду до 45-50 °С. Температура более 45-50 °С не требуется, т.к. скорость растворения компонентов и качество конечного усилителя вкуса не увеличится, кроме того, при температуре более 50°С может произойти частичное или полное разрушение структур применяемых веществ.
3. Закладываем в нижеперечисленной последовательности: сахар, 1-1,5 часть. Более 1,5 части может привести к появлению сладкого вкуса. Менее 1 части готовый раствор не сможет быстро интегрировать в клетку белка. При введении в массу продукта готового ПЛИГ с 1-1,5 частью сахара, концентрация углеводов будет ничтожно мала, и может не учитываться в пищевой ценности продукта.
4. Соль йодированная, 2-2,2 части. Служит вкусовой добавкой. Менее 2 частей не дадут должного вкусового эффекта. Более 2,2 частей — может проявить вкус соли в готовом продукте.
5. Глутамат натрия, 5-6 частей. Усилитель вкуса. Менее 5 частей — не получим должного эффекта. Более 6 частей — не прибавит каких-либо полезных качеств или новых свойств к ПЛИГ.
6. Инозинат натрия, 0,5-0,7 частей. Усилитель вкуса. Менее 0,5 частей — не получим должного эффекта. Более 0,7 частей — не прибавит каких-либо полезных качеств или новых свойств к ПЛИГ.
7. Гуанилат натрия, 0,5-0,7 частей. Усилитель вкуса. Менее 0,5 частей — не получим должного эффекта. Более 0,7 частей — не прибавит каких-либо полезных качеств или новых свойств к ПЛИГ.
8. Янтарная кислота, 0,5-0,7 частей. Синергист сорбата калия, сорбиновой кислоты, синергист усилителей вкуса. Менее 0,5 частей — не получим должного эффекта. Более 0,7 частей — не прибавит каких-либо полезных качеств или новых свойств к ПЛИГ.
9. Лимонная кислота, 1 часть. Консервант, усилитель вкуса.
10. Монопропиленглиголь пищевой, 30-35 частей. Является одновременно влагоувеличивающим и влагоудерживающим компонентом. Менее 30 частей — не получим расчетную, необходимую влажность конечного продукта. Более 35 частей сделает конечный продукт излишне дорогостоящим без проявления в готовом продукте более полезных качеств.
11. Триацетин (глицерилтриацетат) пищевой, 1-1,2 часть. Влагоудерживатель. Способствует проникновению раствора ПЛИГ в жиры инъецированного продукта. Защищает мороженый продукт от высыхания. Менее 1 части — не получим должного эффекта. Более 1,2 частей — не прибавит каких-либо полезных качеств или новых свойств к ПЛИГ.
После полного растворения компонентов выключают ТЭНы и при перемешивании дают раствору остыть до комнатной температуры. Фильтруют через 4 слоя марли. Разливают в тару для хранения холодных пищевых продуктов. Концентрированный усилитель вкуса представляет собой прозрачную жидкость без запаха и вкуса. Срок хранения при температуре от 0 до 12°С составляет не более 60 суток с момента изготовления.
Все применяемые компоненты разрешены к применению для изготовления пищевых продуктов и пищевых добавок Евросоюзом и Роспотребнадзором.
Список использованной литературы
1. Щукин, Е. Д. Коллоидная химия /Е. Д. Щукин, А. В. Перцов, Е. А. Амелина. – М. : Высш. шк., 2004. – 445 с.2. Фролов, Ю. Г. Курс коллоидной химии. Поверхностные явления и дисперсные системы : учебник для вузов / Ю. Г. Фролов.– Изд. 3-е, стереотипное, испр.– М. : ООО ТИД «Альянс», 2004.– 464 с.3. Зимон, А.Д. Коллоидная химия / А. Д. Зимон, Н. Ф. Лещенко. – М. : Агар, 2003. 4. Пищевая химия / А. П. Нечаев, С. Е. Траубенберг, А. А. Кочеткова и др.; под ред. А. П. Нечаева. – СПб. : ГИОРД, 2007. – 640 с.
Ионизированная вода проводит электричество?
Когда какие-либо минералы растворяются в воде, они распадаются на соответствующие анионы, а катион называется ионизированной водой. Проиллюстрируем проводимость в ионизированной воде.
Ионизированная вода состоит из большого количества подвижных ионов, поэтому ионизированная вода может проводить электричество. Когда некоторые ионные соединения растворяются, вода и соответствующие ей ионы вырываются из соединения и стремятся свободно двигаться. Суммарное движение этих подвижных ионов вызывает электрическую проводимость.
Например, обычная вода может немного проводить электричество из-за нескольких растворенных минералов и солей. Между тем, морская вода обладает большей проводимостью, поскольку в ней содержится огромное количество ионов металлов.
Вода и лед
Вода существует в трех агрегатных состояниях: пар, жидкость и лед. Цель этого опыта познакомить детей со свойствами воды и льда и сравнить их.

В 4 формочки для льда наливают воду, и помещают их в морозилку. Чтобы детям было интереснее наблюдать, можно подкрасить воду перед замораживанием разными красителями. В чашку наливают холодную воду, и бросают туда два кубика льда. По поверхности воды поплывут простые ледяные кораблики или айсберги. Этот опыт докажет, что лед легче воды.
Пока кораблики плавают, оставшиеся кубики льда посыпают солью. Смотрят, что будет происходить. Через короткое время, не успеет еще комнатный флот в чашке пойти ко дну (если вода довольно холодная), кубики, посыпанные солью, начнут рассыпаться. Это имеет научное обоснование и объясняется тем, что температура замерзания соленой воды ниже, чем обычной.
Соль спасает от болезней
Терапию солевыми растворами по Болотову можно назвать уникальной за то, что лечение целого списка заболеваний проводится простым и доступным продуктом.
Во время Второй мировой войны белыми волшебными кристаллами были спасены тысячи жизней. Это произошло благодаря разработкам академика Б.В. Болотова. Он на себе испытывал свою методику и доказал, что именно солью можно укрепить иммунитет так, что он будет противостоять микробам и вирусам.
Как же работает методика? Всё дело в том, что 8-10 %раствор пищевой соли — непревзойдённый сорбент. Он вытягивает все нечистоты из любого больного органа. Что нужно сделать? На больное место, в течение 7-10 дней, необходимо накладывать гигроскопичную повязку, смоченную в подсолённой воде.
Соль будет вытягивать микробы, вирусы, отходы жизнедеятельности из самых глубоких слоев кожи.
Когда на орган или больной участок кожи накладывается повязка, то под ней в тканях происходит обновление жидкости, ликвидация любой патологии. Но для лечения необходимо готовить именно 8-10 процентный раствор. Лучше даже 8-9%, чтобы не навредить капиллярам.
Лечение повязками с солью
Гипертоническим раствором поваренной соли не раз вылечивали ожоги 2-3 степени. Необходимо на ожог наложить солевую повязку. Через минуту стихнет острая боль, а спустя несколько дней ожог будет заживать. Марлю надо держать 8-9 часов, после чего применять лечение, назначенное врачом.
Чтобы вылечить гнойные раны, необходимо прикладывать к ране такой же раствор. Его использовали в те далёкие времена, когда лечились только народными средствами. Очищались и затягивались даже самые сложные нагноения, исчезало воспаление. Идеальным считается 9%, раствор, так как схож по составу с человеческой слезой.
Как только повязка попадает на рану, соль начинает вытягивать из неё зараженную жидкость вместе с вирусами и бактериями. На этой способности основано лечение любых нарывов. На нарыв надо приложить горячую солевую повязку, подержать по 8 часов в день до его исчезновения. Утеплять не рекомендуется.
Готовый концентрат можно использовать только в течение суток. На следующий день надо готовить новый. Подогревать до горячего состояния можно только на водяной бане или на плите. В микроволновке нельзя, так как микроволны полностью меняют структуру воды.
Белые кристаллы способны поглощать патогенную жидкость из самых глубинных слоев кожи, мышц, костей вместе с ядами, токсинами, вирусами. Остановить патологический процесс можно в любом гнойнике. На гнойник также накладывается просолённая марля, которую надо чаще менять. Главное, чтобы соль не содержала йод и другие примеси.
ссылки
- Ламберт Н. и Мохаммед М. (1993). Химия для СХС. Оксфорд: Хайнеманн.
- Стин, Д. П. (2008). Двуокись углерода, карбонизация и принципы технологии розлива. В D. P. Steen, Philip и P. R. Ashurst (редакторы), Газированные безалкогольные напитки: разработка и производство, стр. 112-143. Оксфорд: издательство Blackwell.
- Что в воздухе? (с / ф). UCAR Центр Научного Образования. Получено 17 октября 2017 г. с сайта eo.ucar.edu
- Сжиженный нефтяной газ. (2013, 12 июля). Энциклопедия Британника.Получено 16 октября 2017 г. с сайта britannica.com
- Lytle, D.A. and Schock, M.R. (1996). Время застоя, состав, влияние рН и ортофосфата на выщелачивание металла из латуни. Огайо: США Агентство по охране окружающей среды.
- Крабви, Т. Д.; Pelletier, S.J. and Pruett, T.L. (2001). Хирургический Антисепсис В S. S. Block (редактор), Дезинфекция, Стерилизация и Сохранение, стр. 919-934. Филадельфия: Липпинкотт Уильямс и Уилкинс.
- Бирн, Р. Х. и др. (2017, 07 июня). Забортной. Энциклопедия Британника. Получено 17 октября 2017 г. с сайта britannica.com
- Плутовская Б. и Варденцки В. (2012). Газовая хроматография-ольфактометрия алкогольных напитков. В J. Piggott (редактор), Алкогольные напитки: сенсорная оценка и исследования потребителей, стр.101-122. Филадельфия: Издательство Вудхед.
- Что такое туман? (2017, 12 июля). Мет Офис (Великобритания). metoffice.gov.uk
- Хельменстин, А. М … (2016, 16 февраля). Каков химический состав уксуса? Получено 17 октября 2017 г.
- Phinney, D.J. и Halstead, J.H. (2017). Стоматологическая помощь: комплексный подход. Массачусетс: Cengage Learning.
- Britannica, E. (s.f.). Решение-химия. Получено с сайта britannica.com
- Wikipedia. (Н.Д.). Растворимость. Получено с en.wikipedia.org
- Classzone. (Н.Д.). Растворенные вещества. Получено с frsd.k12.nj.us
- ChemGuide. (Н.Д.). Насыщенные растворы и растворимость. Получено с сайта chem.libretexts.org
- Madhusha. (Н.Д.). Разница между растворителем и растворенным веществом. Получено с сайта pediaa.com.
Лечение бородавок и папиллом солью
Бородавки на теле, особенно на лице выглядят некрасиво, поэтому каждый человек хотел бы от них избавиться.
Противовирусное действие белых кристаллов высоко оценили народные целители. С помощью солевых примочек хорошо лечатся всевозможные кожные заболевания: экзема, псориаз, бородавки, папилломы, пигментные пятна. Рак кожи тоже не может противостоять хлористому натрию, особенно в начальной стадии.
Как воздействовать на бородавки и другие наросты:
- Сначала пораженный участок необходимо обработать антисептиком;
- Смочить водой;
- На влажный диск насыпать мелкой соли, затем натереть новообразование.
Такую процедуру придется делать целый день каждые 2–3 часа. Отрывать новообразование нельзя, оно должно отвалиться само. Потом его можно сдать в лабораторию, чтобы убедиться в его доброкачественности.
Очень простой рецепт избавления от бородавок на руках: в мешочек насыпать соль, руки ввести в мешок и начинать «мыть» руки солью. Через несколько сеансов руки очистятся.
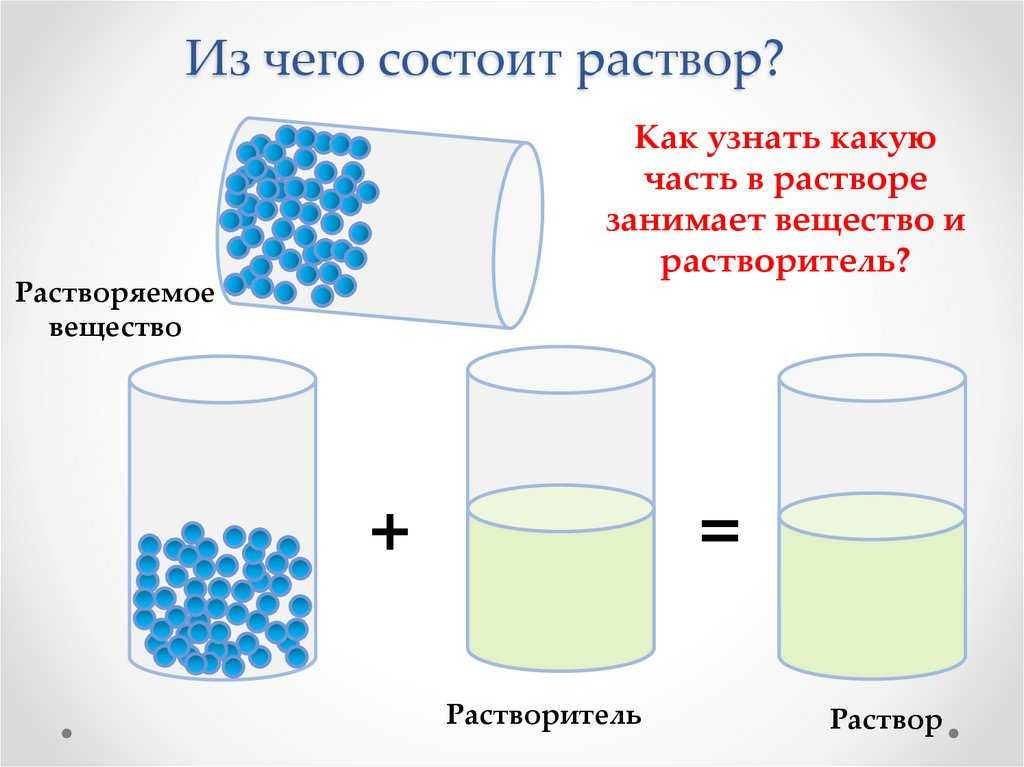
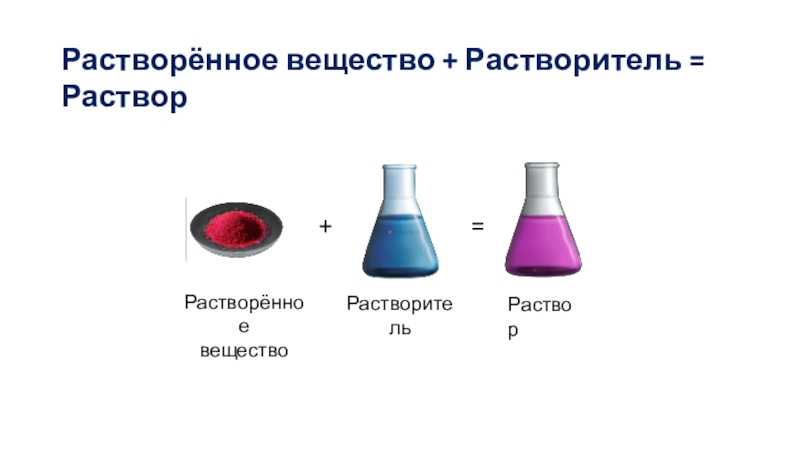
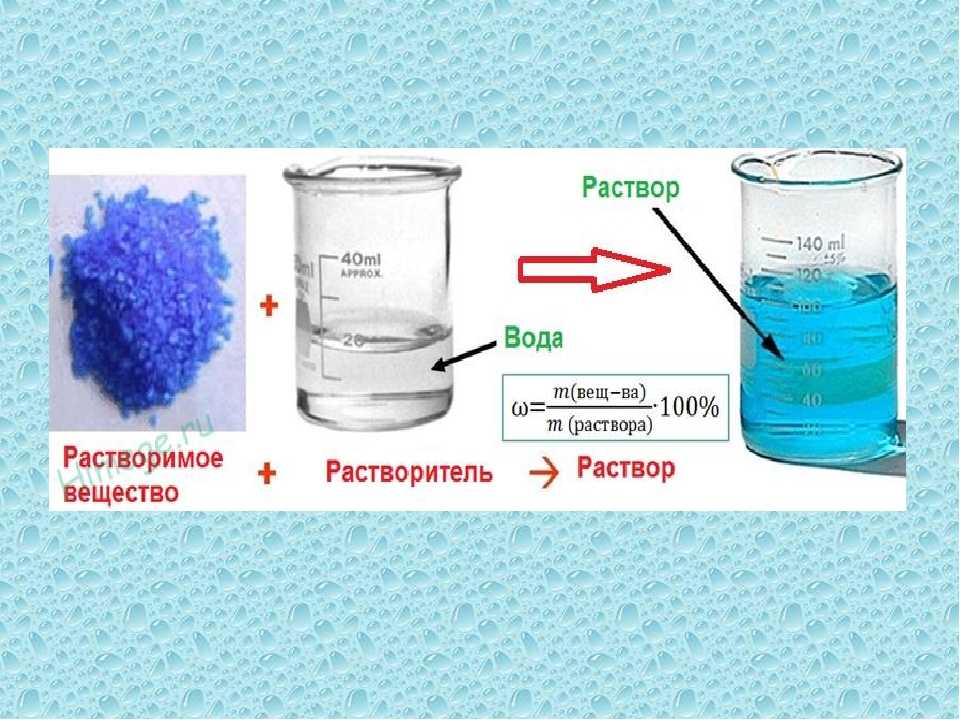
Растворы, растворители и растворимость

Растворы (на латинском «solution«) – жидкие лекарственные формы, получаемые путем растворения жидких, твердых и газообразных веществ в соответствующем растворителе, предназначенные для наружного, внутреннего, парентерального применения.
Растворы имеют огромное значение в природе, науке и технике. Отличие растворов от других смесей в том, что частицы составных частей распределяются в нем равномерно, и в любом микрообъеме такой смеси состав будет одинаков.
Физическая теория растворов:
Основоположенниками были Вант Гофф, Оствальд, Лррениус, которые считали, что процесс растворения является результатом диффузии (процесс взаимного перемешивания веществ).
Химическая теория растворов:
В противоположность физической теории растворов — Д.И. Менделеев доказывал, что растворение является результатом химического взаимодействия растворенного вещества с молекулами воды и что правильнее определять раствор как однородную систему, которая состоит из частиц растворенного вещества, растворителя и продуктов их взаимодействия.
Современная физико-химическая теория растворов:
Ее предсказывал еще в 1906 г. Д. И. Менделеев, которую он описал в своем учебнике «Основы химии»: «Две указанные стороны растворения и гипотезы, до сих пор приложенные к рассмотрению растворов, хотя имеют отчасти различные исходные точки, но без всякого сомнения, по всей вероятности, приведут к общей теории растворов, потому что одни общие законы управляют как физическими, так и химическими явлениями».
Требования к растворителям:
- Хорошая растворяющая способность
- Инертность к растворенному веществу и аппаратуре;
- Минимальная токсичность, огнеопасность;
- Микробная устойчивость;
- Растворитель должен получаться быстро и дешево, не иметь неприятного вкуса и запаха;
- Должен быть фармакологически индифферентным.
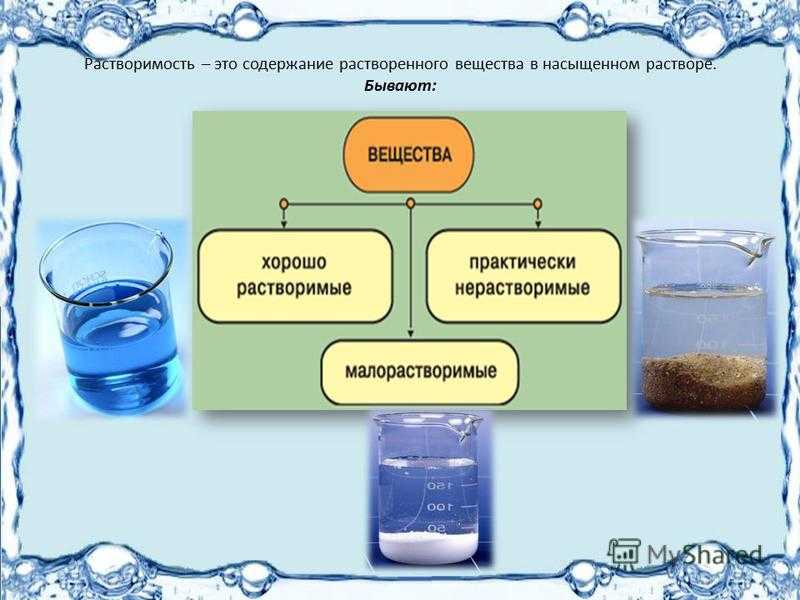
Растворимость
Растворимость (определение растворимости) — способность вещества в смеси с одним или несколькими другими веществами образовывать растворы. Растворимость веществ различна. Существует таблица в Государственной Фармакопее характеризующая растворимость лекарственных веществ в зависимости от количества растворителя.
| Условный термин | Количество растворителя, необходимое для растворения 1,0 вещества, мл |
| Очень легко растворим | До 1 |
| Легко растворим | От 1 до 10 |
| Растворим | От 10 до 30 |
| Умеренно растворим | От 30 до 100 |
| Мало растворим | От 100 до 1000 |
| Очень мало растворим | От 1000 до 10000 |
| Практически нерастворим | От 10000 |
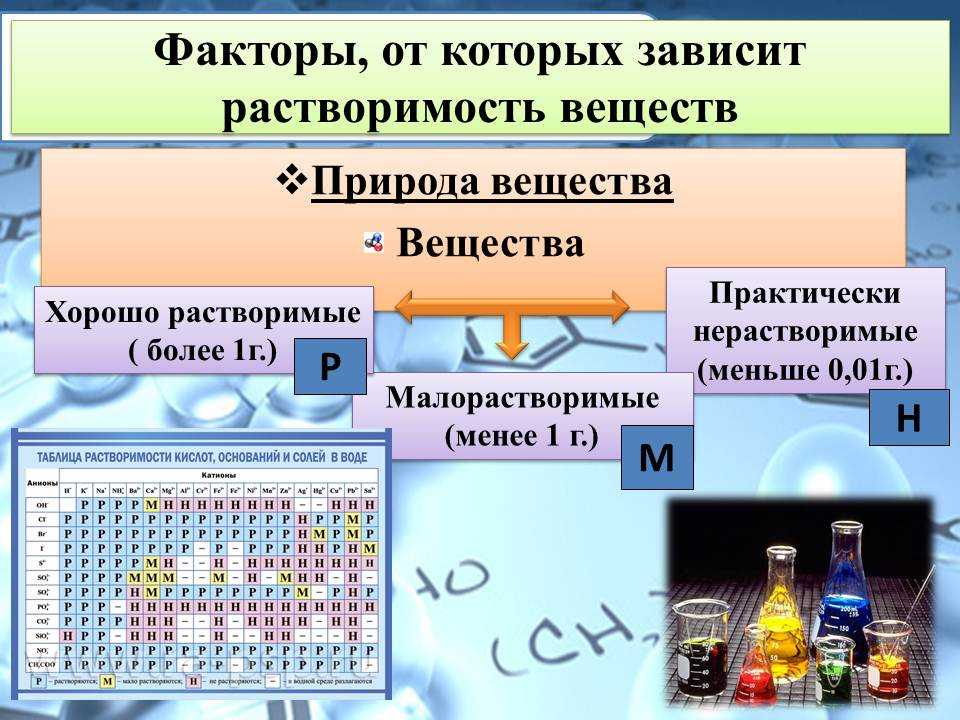
Растворимость зависит от:
- Температуры при которой происходит растворение (для большинства веществ растворимость при повышении температуры увеличивается, исключение составляет кальция глицерофосфат, его растворимость уменьшается при повышении температуры);- Свойств растворителя (подобное растворяется в подобном);
- От предела растворимости. Каждое вещество имеет свой предел растворимости (ПР).
Предел растворимости – наибольшее количество лекарственного вещества, которое может раствориться в данном растворителе при данной температуре.
https://youtube.com/watch?v=TANdGXxE_p8
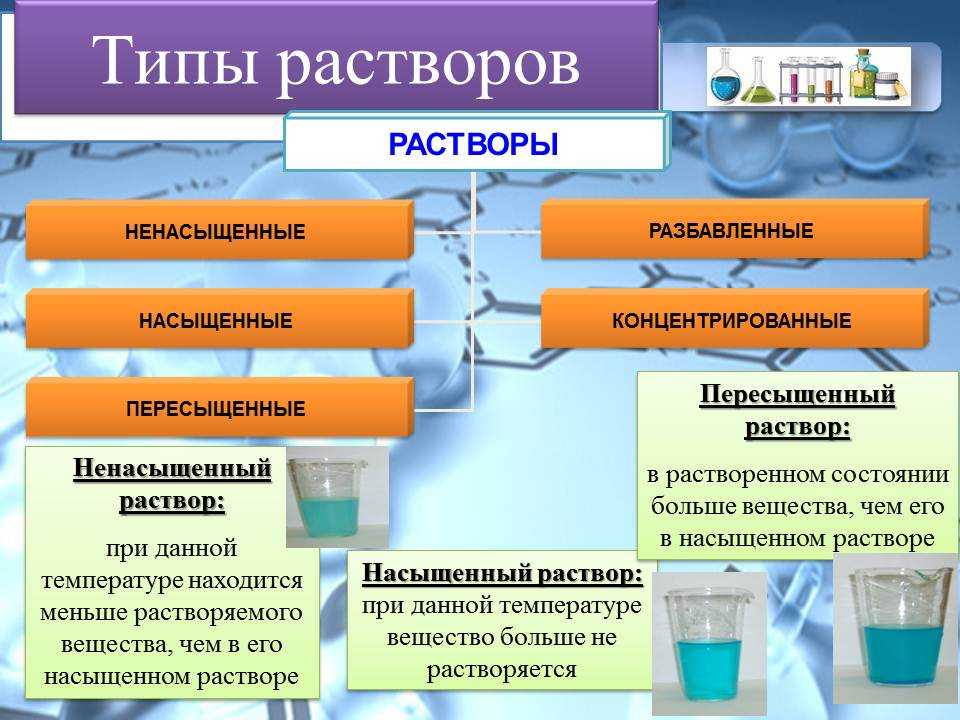
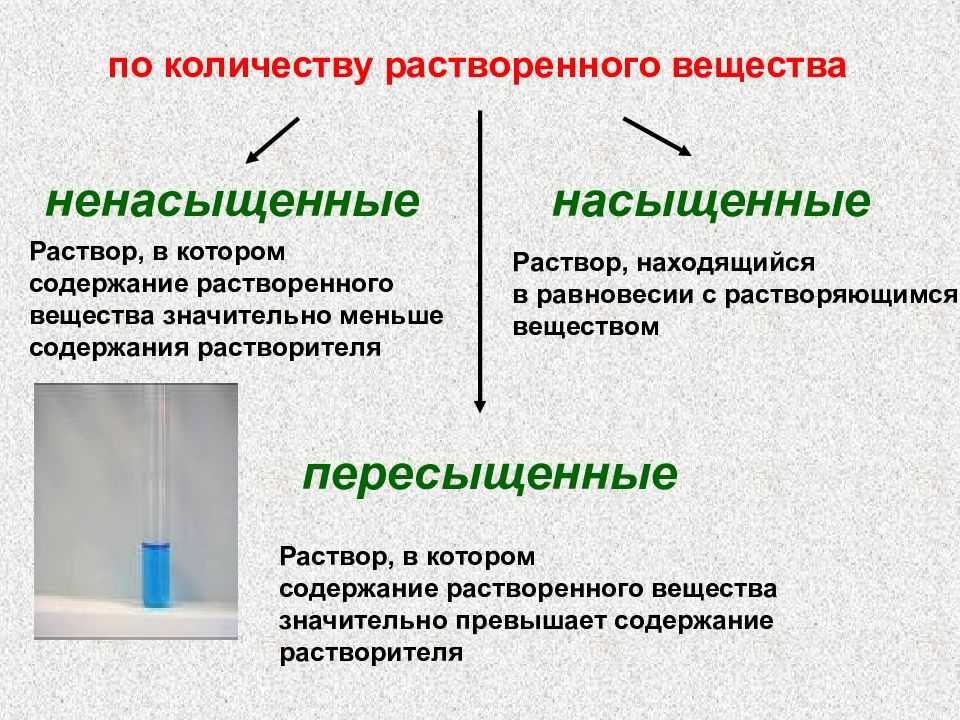
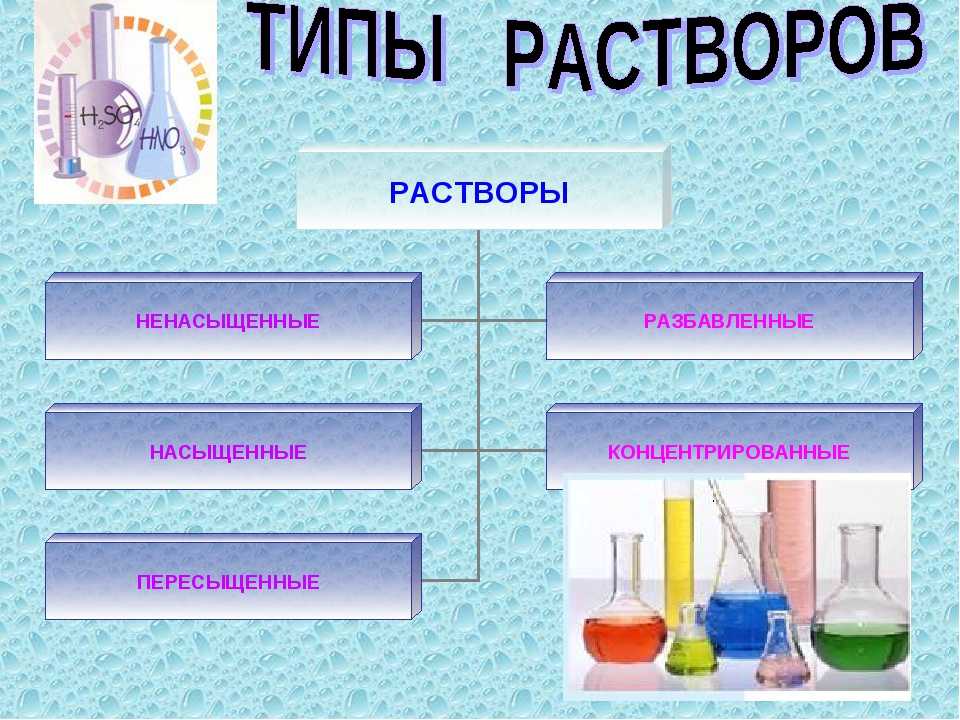
В зависимости от количества растворенного вещества растворы делятся на три группы:
- Ненасыщенные – не достигнут предел растворимости;
- Насыщенные – достигнут предел растворимости;
- Перенасыщенные – предел растворимости превышен (данные растворы готовят при нагревании, но при охлаждении избыток вещества выпадает в осадок).
В медицинской практике используются в основном ненасыщенные растворы.
Процессы ускоряющие растворимость
Некоторые вещества растворяются медленно, хотя в значительных количествах, с целью ускорения растворения таких веществ прибегают к следующим приемам:
1) Растворению при нагревании или использование горячего растворителя:
- горячий растворитель используется при приготовлении растворов сульфацила натрия, борной кислоты, растворов глюкозы в больших концентрациях, перманганата калия;- масляные, глицериновые растворы готовят при нагревании;
- фурацилин растворяют при нагревании раствора на открытом огне.
2) Перед растворением вещества измельчают (кристаллогидраты — магния сульфат, натрия тетраборат, меди сульфат);
3) Перемешивание;
4) Вещества помещают в верхний слой растворителя (протаргол, йод).
Поведение веществ в растворе
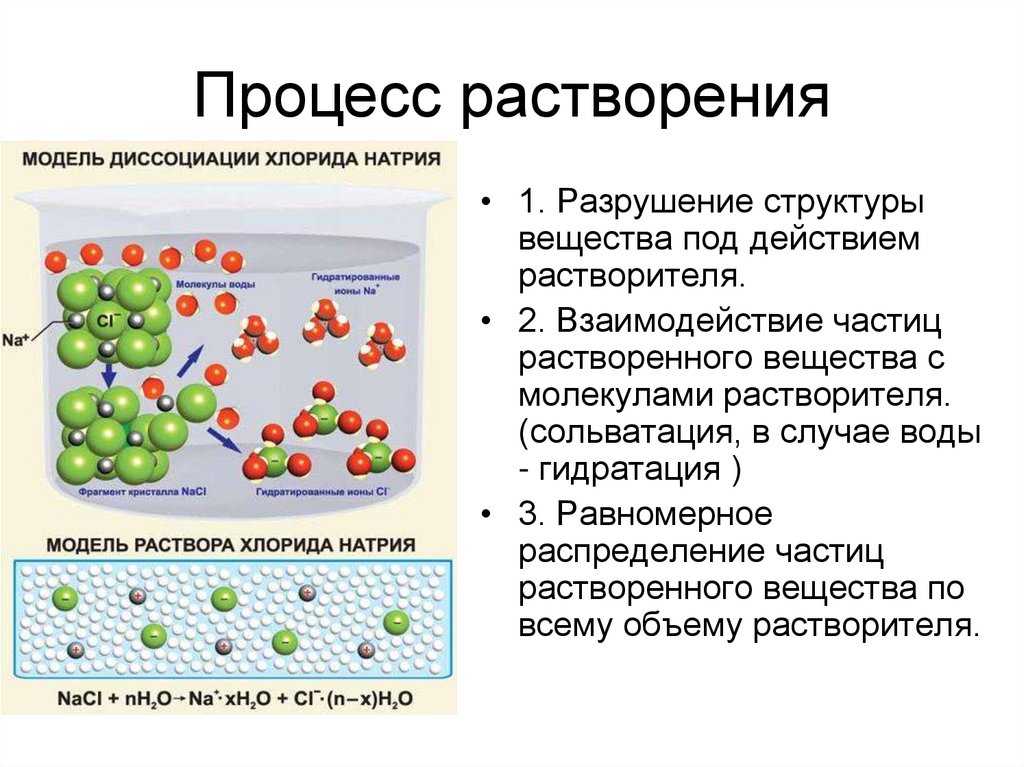
Растворение
— это физико-химический процесс. Он сочетает в себе физический процесс (дробление до молекул) и химическое воздействие компонентов (образование в воде непрочных соединений — гидратов). В процессе растворения молекулы воды разрушают кристаллы растворяемого вещества. Это разрушение происходит в месте соприкосновения кристалла с водой. Чем больше площадь поверхности соприкосновения, тем быстрее разрушаются кристаллы. В результате диффузии происходит самопроизвольное распределение частиц одного вещества между частицами другого, что приводит к образованию раствора. Для улучшения контакта вещества с растворителем увеличивают площадь поверхности соприкосновения, вещества измельчают и раствор перемешивают.
В результате химического взаимодействия вещества с водой образуются соединения — гидраты. О химическом взаимодействии говорят такие признаки химических реакций, как тепловые явления при растворении: растворение H
2
SO
4
сопровождается выделением тепла, растворение NaCl, NH
4
NO
3
— охлаждением. Косвенным доказательством гидратации является существование твердых
кристаллогидратов
— солей, в состав которых входят вода, например медный купорос CuSO
4
х 5Н
2
O.
Примеры приготовления пищевых растворов
Пример 1. Берут 700 г кристаллического сахара, добавляют 300 мл воды, нагревают до 75 oC, фильтруют, добавляют 10 г активного угля при перемешивании, смесь фильтруют, добавляют 20 г низкоосахаренной крахмальной патоки с содержанием, тщательно перемешивают в течение 15 минут и охлаждают до 200C. Получают 1020 г сиропа.
Пример 2. Берут 700 г кристаллического сахара, добавляют 300 мл воды, нагревают до 95 oC, фильтруют, добавляют 10 г активного угля при перемешивании, смесь фильтруют, добавляют 50 г низкоосахаренной крахмальной патоки, тщательно перемешивают в течение 15 минут и охлаждают до 20 0C. Получают 1050 г сиропа.
Пример 3. Берут 635 г кристаллического сахара, добавляют 365 мл воды, нагревают до 75 oC, фильтруют, добавляют 10 г активного угля при перемешивании, смесь фильтруют и охлаждают до 20 oC. Получают 1000 г, pH 6,9.
Всегда ли можно растворить одно вещество в другом?
Оказывается, не всегда. Некоторые из них просто не хотят и не могут «дружить». Например, масло и вода. Как же сделать их смесь?
В стакан налей 2—3 чайные ложки воды, добавь несколько капель пищевого красителя и хорошо перемешай. Затем в окрашенную воду влей 2—3 чайные ложки растительного масла и снова тщательно перемешай.
Поставь стакан и наблюдай за тем, что происходит. Сначала может создаться впечатление, что обе жидкости перемешались, однако спустя некоторое время масло окажется на поверхности. Несмотря на то, что вода хорошо смешивается с другими жидкостями и образует различные растворы, этого не происходит в случае с маслом. Молекулы воды сильно связаны друг с другом, как и молекулы масла, именно поэтому такие две жидкости невозможно смешать.
Поделиться ссылкой
черты
Растворенные вещества содержат огромное количество химических веществ в разных состояниях, имеют различную способность растворяться и имеют многочисленные характеристики, которые играют важную роль в образовании гомогенных смесей. Некоторые из основных характеристик растворенных веществ следующие:
растворимость
Растворимость — это способность соединения растворяться в другом веществе. Эта способность тесно связана с смешиваемостью, то есть способностью жидкости смешиваться с определенной; Если вы не можете присоединиться, это несмешиваемость.
Смешиваемость имеет диапазон больше, чем конкретное число, поэтому можно сказать, что одно вещество полностью, частично или не смешивается с другим.
Растворимость растворенного вещества зависит, в свою очередь, от других факторов, которые могут увеличивать или уменьшать эту емкость из-за их влияния на баланс межмолекулярных сил, которые создаются между растворенным веществом и растворителем..
Даже менее ожидаемые особенности, такие как размер капли растворенного вещества или порядок в структуре кристалла, могут влиять на их способность растворяться.
температура
Температура системы, в которой растворяется растворенное вещество, может влиять на его растворимость: для большинства твердых веществ и жидкостей они увеличивают его способность растворяться в зависимости от повышения температуры.
В отличие от этого, в газах наблюдается сложное поведение, которое проявляется в меньшей растворимости в воде при более высоких температурах, но большей в органических растворителях..
Насыщенность раствора
Это называется насыщением раствора до степени, в которой раствор растворяет растворенное вещество, и называется насыщенным раствором до того, которое растворило как можно больше растворенного вещества. С этого момента добавленное растворенное вещество будет осаждаться в виде избытка на дне использованного контейнера; до этого решение называется ненасыщенным.
Можно пройти точку насыщения и продолжить растворение растворенного вещества, но это требует повышения температуры. Раствор, который содержит избыток растворенного вещества и который был нагрет, называется перенасыщенным раствором.
давление
Изменения давления обычно не влияют на растворимость твердых веществ и жидкостей, за исключением некоторых исключительных случаев (накопление сульфата кальция в нефтяных трубах), но в газах это является определяющим фактором их способности растворяться.
Фактически растворимость газа в растворителе прямо пропорциональна парциальному давлению этого газа в указанном растворителе..
полярность
Полярность растворенного вещества имеет решающее значение при измерении его растворяющей способности; растворенное вещество лучше растворяется в растворителе, химическая структура которого аналогична.
Например, высокополярные или гидрофильные вещества будут иметь более высокую растворимость в высокополярных растворителях, в то время как они будут практически нерастворимы в неполярных веществах..
Аналогично, межмолекулярные силы играют важную роль в сольватации и в той легкости, с которой растворитель может растворять растворенное вещество: чем больше диполь-дипольные силы, водородные связи и другие связи, тем больше способность растворителя растворяться растворить и сформировать решение.
Эксперимент со льдом
На первый взгляд можно подумать, что кубик льда, находясь сверху, в конечном итоге плавится, за счет чего и должен заставить воду разлиться, но так ли это на самом деле?
Вам понадобятся:
- Стакан
- Вода
- Кубики льда.
Инструкция:
1.
Заполните стакан теплой водой до самого края.
2.
Осторожно опустите кубики льда. 3
3.
Наблюдайте внимательно за уровнем воды.
По мере таяния льда уровень воды совершенно не меняется.
Объяснение
Когда вода замерзает, превращаясь в лед, она расширяется, увеличивая свой объем (вот почему зимой могут разрываться даже отопительные трубы). Вода из растаявшего льда занимает меньше места, чем сам лед. Поэтому когда кубик льда тает, уровень воды остается примерно такой же.
Почему вода в море соленая
Часть соли в воду попадает с морского дна, в котором есть содержащие соли камни, из которых и попадает соль в воду. Хлорид натрия также может поступать и из вулканических клапанов. Но в большей степени соли поступают с материков. Один килограмм морской воды в среднем содержит в себе до 35 граммов соли, причем, большая часть (примерно 85 %) – хлорид натрия (известная всем кухонная соль).
Источники поступления соли в море:
- Выветривание скал: когда промокают камни, из них смываются вещества, и соли уносятся в моря (подобное действие происходит и со скалами на морском дне).
- Взрывы вулканов подводных: они выпускают в воду лаву, реагирующую с морской водой и растворяющую в ней некоторые вещества.
Вода имеет способность проникать в трещины, лежащие на глубине океана в зонах срединно-океанических хребтов. Камни там горячие (на дне часто бывает лава). Вода, нагреваясь в трещинах, растворяет большое количество солей из подводных пород, которые попадают в морскую воду.
Почему вода в море соленая? Потому что хлорид натрия – наиболее распространенная в ней соль в связи с тем, что именно она лучше всех веществ растворяется. Однако кремний и кальций тоже приносятся реками в океаны в большом количестве. При этом в морской воде их не так уж и много. Связано это с тем, что кальций «подбирается» различными водными животными (кораллами, брюхоногими и двустворчатыми моллюсками), а кремний используется микроскопическими водорослями (создаются клеточные стенки).
Солнце вызывает испарение огромного количества воды в морях и океанах. Из выпаренной воды остается соль, концентрирующаяся в море. Поэтому вода становится соленой. Следует отметить, что некоторая соль осаждается на морском дне. Благодаря этому поддерживается баланс концентрации соли в воде, иначе море становилось бы еще более соленым.