«Простые и сложные вещества»
Ключи: агрегатные состояния веществ, кристаллическая решетка, вещества молекулярного и немолекулярного строения, простые и сложные вещества, аллотропия.
Содержание (быстрый переход):
Агрегатные состояния вещества
Вещества могут существовать только в трёх агрегатных состояниях: газообразном, жидком и твёрдом.
В газообразном состоянии вещество существует в виде отдельных частиц (молекул, атомов или ионов). Расстояние между частицами в газах намного превышает размеры этих частиц. В жидкостях расстояние между отдельными частицами намного меньше, поэтому силы взаимного притяжения между ними существенно больше, чем в газах. В то время как частицы, составляющие твёрдое тело (атомы, молекулы или ионы), плотно упакованы и совершают колебательные движения. Различают кристаллические и аморфные твёрдые тела.
Для кристаллических веществ характерно упорядоченное расположение частиц, из которых они состоят. Например, снежинка имеет совершенную форму благодаря тому, что молекулы воды, из которых она состоит, располагаются упорядоченно по отношению друг к другу. Правильная форма кристаллов обусловлена особенностями их внутреннего строения. В кристаллах ионы, атомы или молекулы расположены в определённом порядке, на определённых расстояниях друг от друга.
Совокупность точек пространства, в которых располагаются частицы, образующие кристалл, называют КРИСТАЛЛИЧЕСКОЙ РЕШЁТКОЙ.
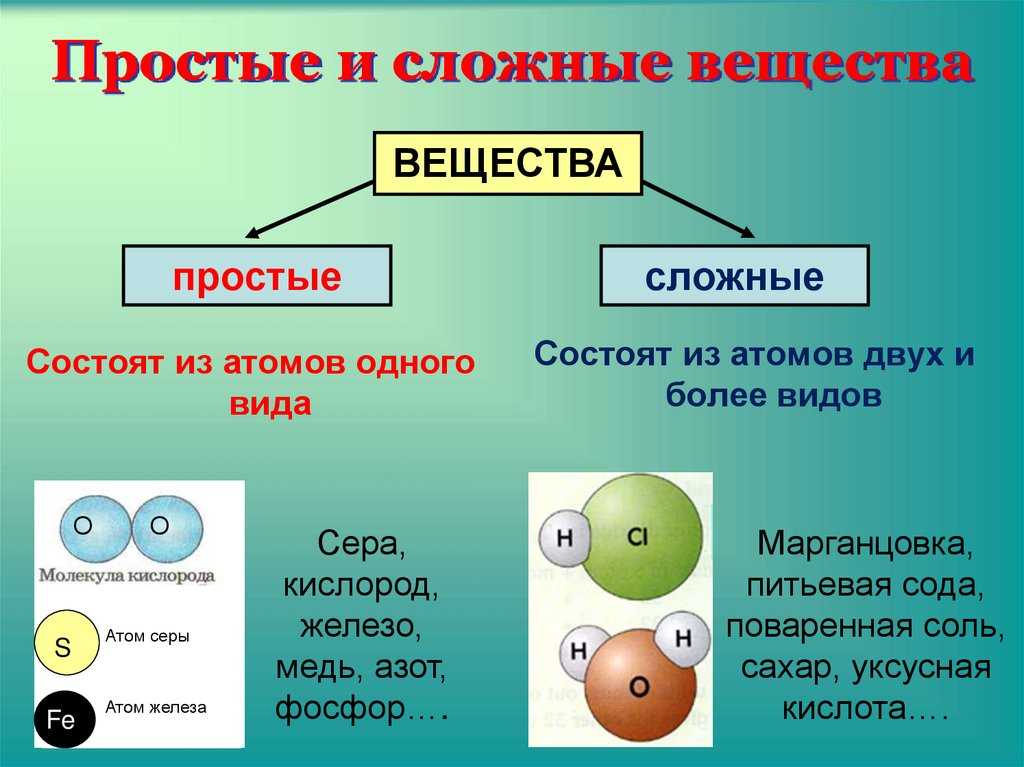
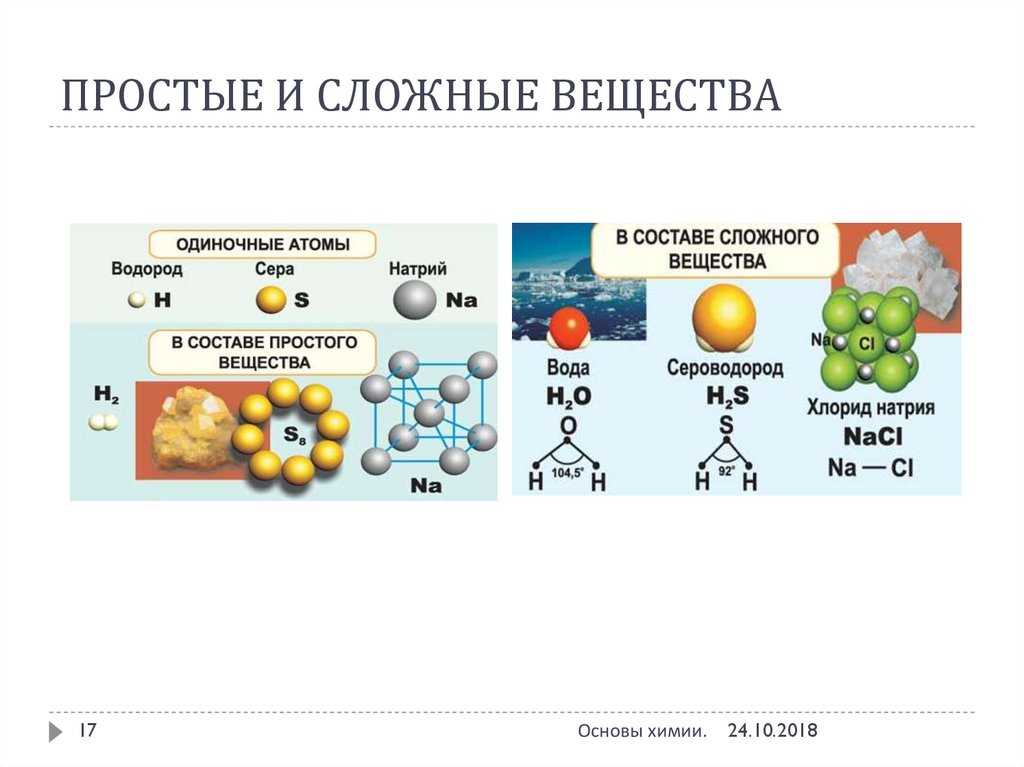
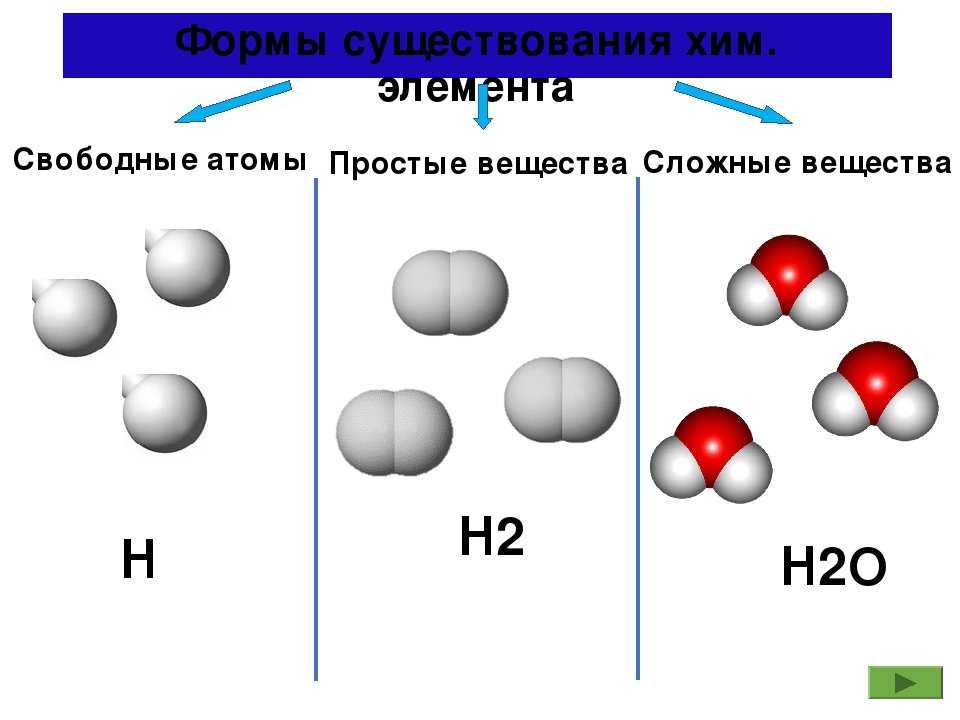
Вещества, которые состоят из молекул, — это вещества молекулярного строения. А вещества, которые состоят из атомов или ионов, — это вещества немолекулярного строения.
Вещества с молекулярным и немолекулярным строением существенно различаются по своим свойствам. Чтобы расплавить вещество, необходимо разрушить его кристаллическую решётку. Оказывается, что в кристаллической решётке связи между молекулами гораздо слабее, чем связи между атомами или ионами. Поэтому, как правило, вещества с молекулярным строением имеют низкие температуры плавления и кипения. Такие вещества часто летучи и имеют запах.
Вещества с немолекулярным строением имеют высокие температуры плавления и кипения. Эти вещества твёрдые, нелетучие и не имеют запаха.
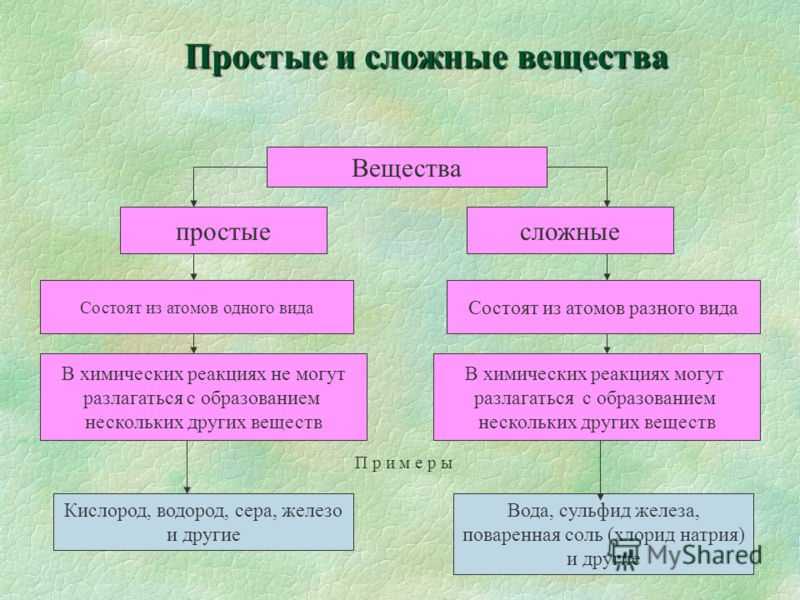
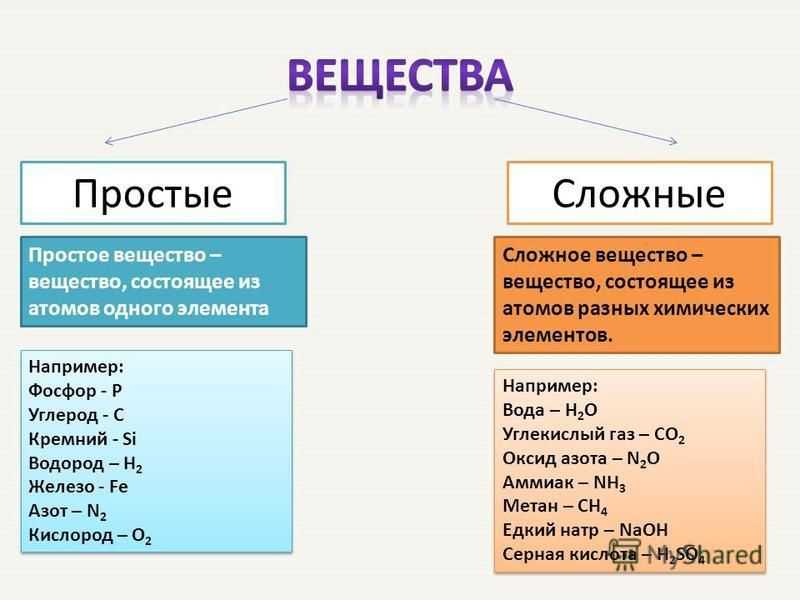
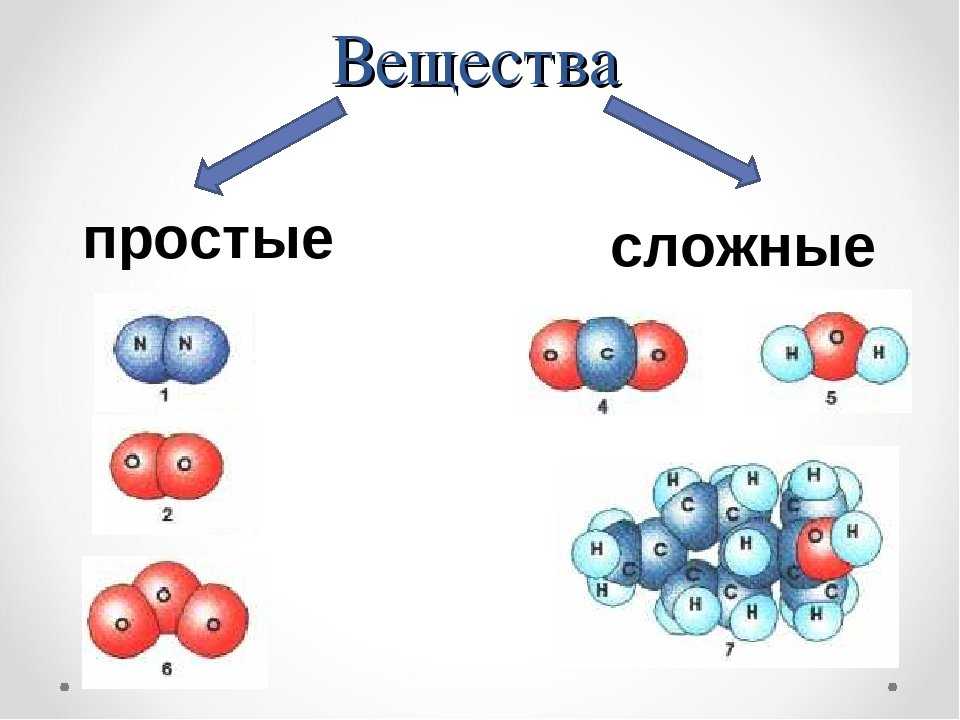
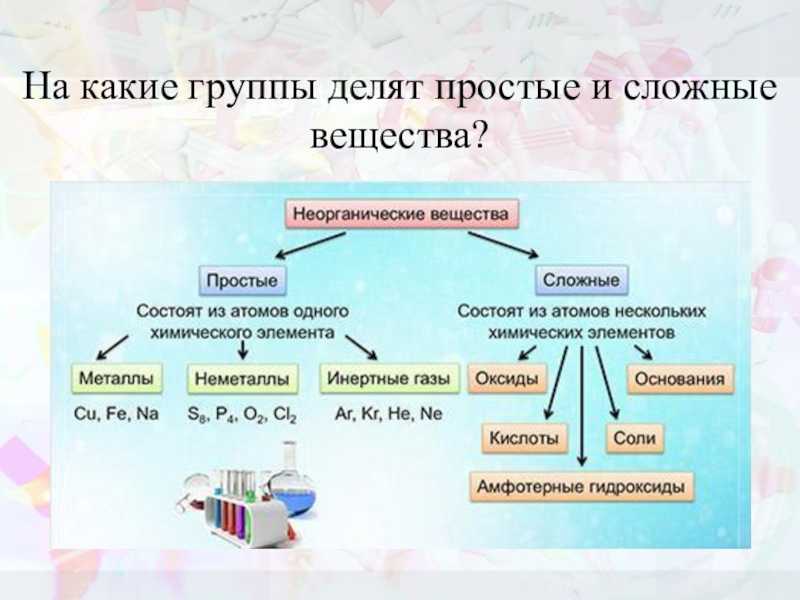
Простые и сложные вещества
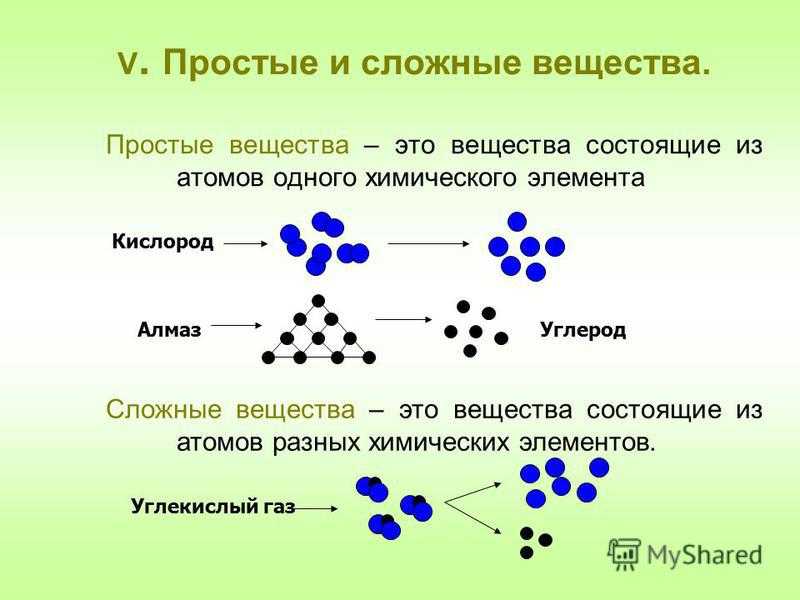
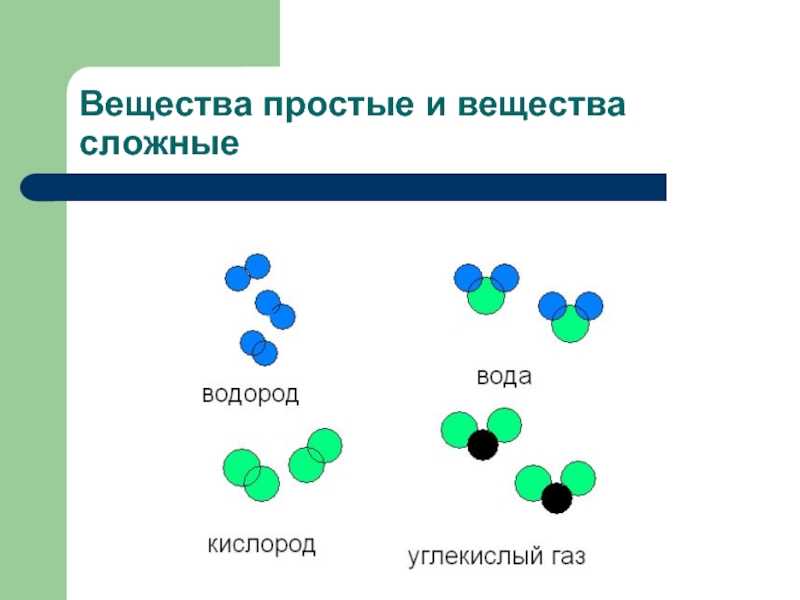
Сложные вещества — это вещества, которые образованы атомами разного вида. Например, такое сложное вещество, как вода, состоит из атомов кислорода и водорода, углекислый газ — из атомов углерода и кислорода.
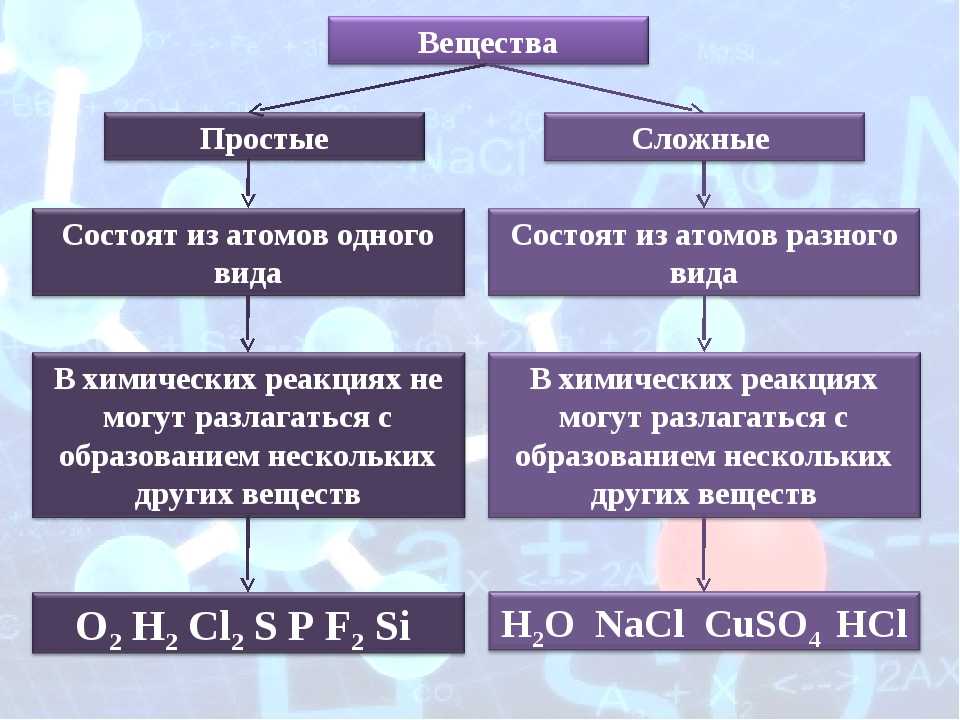
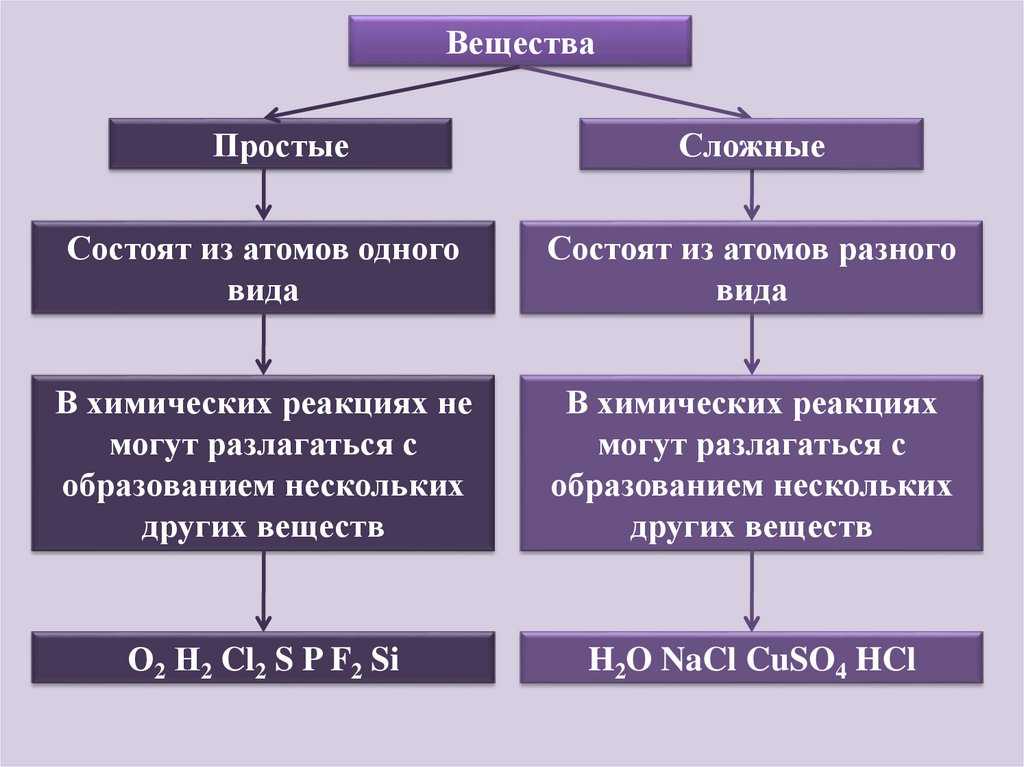
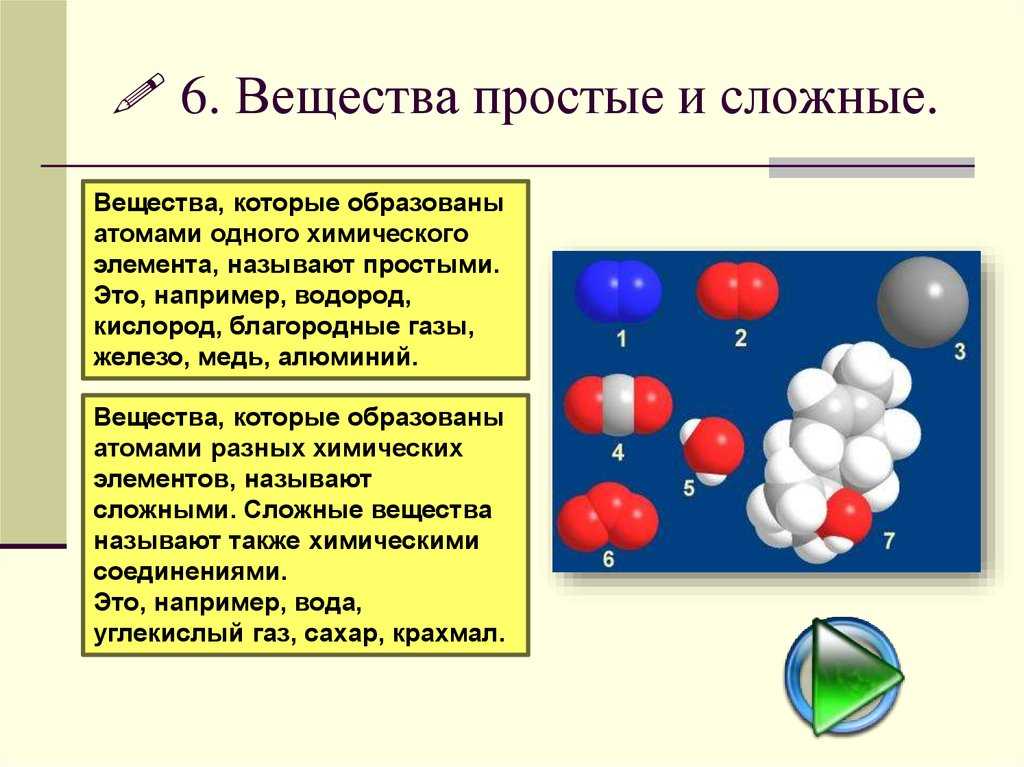
Такие вещества, как, например, сера, железо, кислород и водород, нельзя ни получить из более простых веществ, ни разложить. Эти вещества относят только к простым веществам.
Простые вещества — это вещества, которые образованы атомами одного вида. Например, простое вещество кислород состоит только из атомов кислорода, простое вещество графит — только из атомов углерода.
Сложные вещества и простые вещества молекулярного строения часто называют химическими соединениями.
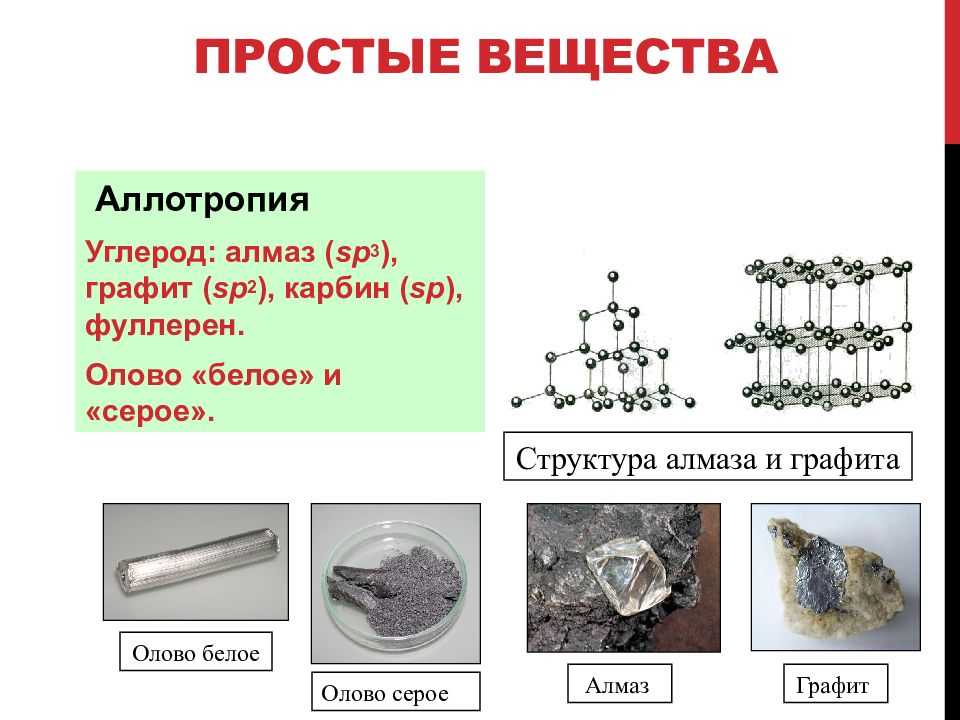
Аллотропия
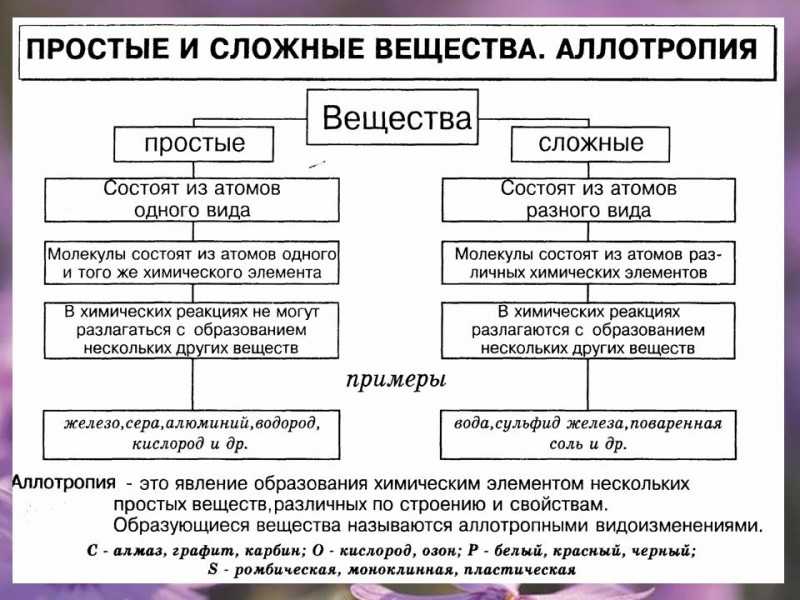
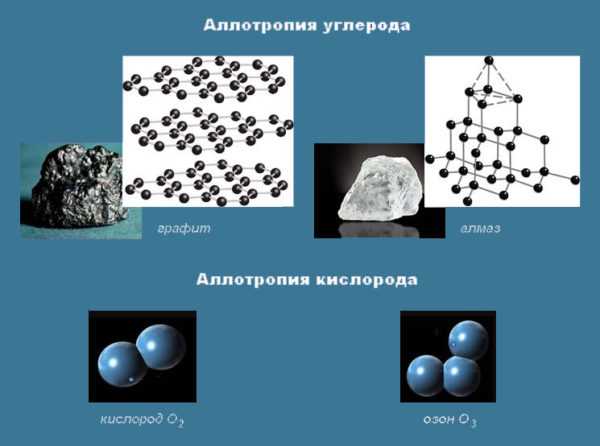
Аллотропия — это явление образования химическим элементом нескольких простых веществ, различных по строению и свойствам. Образующиеся вещества называются аллотропными видоизменениями. Примеры аллотропии:
С (углерод) — алмаз, графит, карбин, фуллерен, графин;О (кислород) — собственно кислород, озон;Р (фосфор) — белый, красный, черный, фиолетовый;S (сера) — ромбическая, моноклинная, пластическая;Si (кремний) — аморфный, кристаллический;As (мышьяк) — желтый, серый, черный.
К примеру, у азота аллотропных модификаций нет.
Конспект урока «Простые и сложные вещества».
Следующая тема: «Химические элементы и их знаки».
Вопросы и задания
- Выберите правильное окончание утверждения: формульная единица сульфата индия In2(SO4)3 содержит…
- 5 химических элементов;
- 3 химических элемента;
- 3 атома.
- В каком из высказываний речь идет о химическом элементе, а в каком – о простом веществе?
- калий входит в состав поташа;
- калий – мягкий серебристо-белый металл.
- Выберите правильное окончание утверждения: к простым веществам относится…
- негашеная известь;
- озон;
- аммиак.
- Составьте из предложенного перечня три списка: а) химические элементы; б) простые вещества; в) сложные вещества.
графит, вода, метан, углерод, красный фосфор.
- Напишите формулу вещества, молекула которого содержит атомы углерода и кислорода в соотношении 1:2. К какому классу соединений оно относится?
- соли;
- кислотные оксиды;
- основные оксиды.
- Определите вещество, которое образуется в реакции соединений SO3 и H2O. Классифицируйте его, выбрав вариант из списка:
- щелочь;
- соль;
- кислота.
- Заполните пропуски:
- сульфат натрия Na2SO4 – соль … кислоты;
- ZnOH — … гидроксид;
- основание …OH – продукт реакции … оксида Li2O с водой.
Ответы
- б).
- а) химический элемент; б) простое вещество.
- б) озон.
- а) углерод; б) графит, красный фосфор; в) вода, метан.
- Химическая формула – CO2, класс – б) кислотный оксид.
- Серная кислота H2SO4, вариант б).
а) сульфат натрия Na2SO4 – соль серной кислоты; б) ZnOH – амфотерный гидроксид; в) основание LiOH – продукт реакции основного оксида Li2O с водой.
Сложные вещества / молекулы
Хотя существуют и одноатомные молекулы, обычно в молекуле более одного атома. В состав одних молекул входят атомы одного и того же элемента, как в O2, а в состав других — разных, как, например, в СO2. Но из этих двух веществ сложное — СO2, поскольку содержит атомы разных элементов, соединенные химическими связями. Итак, молекулы составляют сложное вещество, но любое ли сложное вещество состоит из молекул? Карты нам путают ионы. Есть сложные вещества, которые состоят из этих заряженных частиц, а не из молекул. В поваренной соли, к примеру, ионы натрия (Na+) химически связаны с ионами хлора (CI) в обширной упорядоченной, повторяющейся кристаллической структуре. Таким образом, независимых отдельных «молекул» хлорида натрия в образце соли, говоря строго, нет. Поэтому химическая формула NaCI показывает нам лишь соотношение ионов натрия и ионов хлора в веществе, а не описывает его молекулярный состав. С другой стороны, химики вполне могут походя говорить о «молекулах хлорида натрия».
Страницы
- Главная страница
- ОСНОВЫ ОБЩЕЙ ХИМИИ
- 1.1 Важнейшие классы неорганических веществ
- 2.1 Вещества. Атомы
- 2.2 Размеры атомов
- 2.3 Молекулы. Химические формулы
- 2.4 Простые и сложные вещества
- 2.5 Валентность элементов
- 2.6 Моль. Молярная масса
- 2.7 Закон Авогадро
- 2.8 Закон сохранения массы веществ
- 2.9 Вывод химических формул
- 3.1 Строение атома. Химическая связь
- 3.2 Строение атома
- 3.4 Строение электронной оболочки атома
- 3.5 Периодическая система химических элементов
- 3.6 Зависимость свойств элементов
- 3.7 Химическая связь и строение вещества
- 3.8 Гибридизация орбиталей
- 3.9 Донорно-акцепторный механизм образования
- 3.10 Степени окисления элементов
- 4.1 Классификация химических реакций
- 4.2 Тепловые эффекты реакций
- 4.3 Скорость химических реакций
- 4.4 Необратимые и обратимые реакции
- 4.5 Общая классификация химических реакций
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- 5.1 Растворы. Электролитическая диссоциация
- 5.2 Количественная характеристика состава растворов
- 5.3 Электролитическая диссоциация
- 5.4 Диссоциация кислот, оснований и солей
- 5.5 Диссоциация воды
- 5.6 Реакции обмена в водных растворах электролитов
- 5.7 Гидролиз солей
- 6.1 Важнейшие классы неорганических веществ
- 6.2 Кислоты, их свойства и получение
- 6.3 Амфотерные гидроксиды
- 6.4 Соли, их свойства и получение
- 6.5 Генетическая связь между важнейшими классами
- 6.6 Понятие о двойных солях
- 7.1 Металлы и их соединения
- 7.2 Электролиз
- 7.3 Общая характеристика металлов
- 7.4 Металлы главных подгрупп I и II групп
- 7.5 Алюминий
- 7.6 Железо
- 7.7 Хром
- 7.8 Важнейшие соединения марганца и меди
- 8.1 Неметаллы и их неорганические соединения
- 8.2 Водород, его получение
- 8.3 Галогены. Хлор
- 8.4 Халькогены. Кислород
- 8.5 Сера и ее важнейшие соединения
- 8.6 Азот. Аммиак. Соли аммония
- 8.7 Оксиды азота. Азотная кислота
- 8.8 Фосфор и его соединения
- 8.9 Углерод и его важнейшие соединения
- 8.10 Кремний и его важнейшие соединения
- ОРГАНИЧЕСКАЯ ХИМИЯ
- 9.1 Основные положения органической химии. Углеводороды
- 9.2 Электронные эффекты заместителей в органических соединениях
- 9.3 Предельные углеводороды (алканы)
- 9.3.1 Насыщенные УВ. Метан
- 9.4 Понятие о циклоалканах
- 9.5 Непредельные углеводороды
- 9.6 Диеновые углеводороды (алкадиены)
- 9.7 Алкины
- 9.8 Ароматические углеводороды
- 9.9 Природные источники углеводородов
- 10.1 Кислородсодержащие органические соединения
- 10.2 Фенолы
- 10.3 Альдегиды
- 10.4 Карбоновые кислоты
- 10.5 Сложные эфиры. Жиры
- 10.6 Понятие о поверхностно-активных веществах
- 10.7 Углеводы
- 11.1 Амины. Аминокислоты
- 11.2 Белки
- 11.3 Понятие о гетероциклических соединениях
- 11.4 Нуклеиновые кислоты
- 12.1 Высокомолекулярные соединения
- 12.2 Синтетические волокна
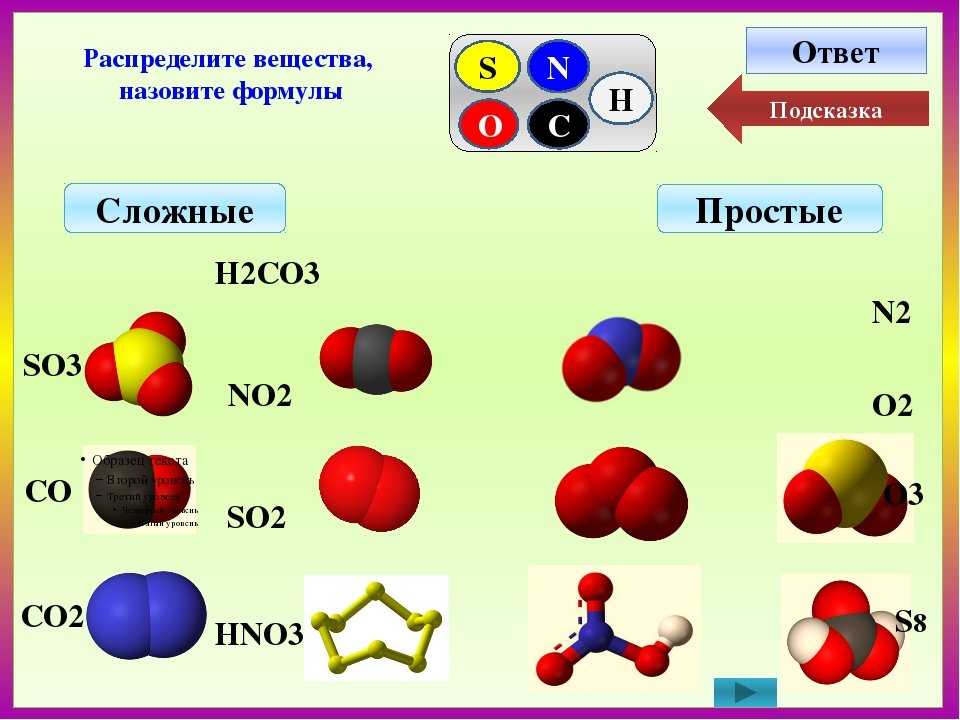
Простые вещества и их классификация
При изучении материала предыдущих параграфов, вы уже познакомились с некоторыми веществами. Так, например, молекула газа водорода, состоит из двух атомов химического элемента водорода –
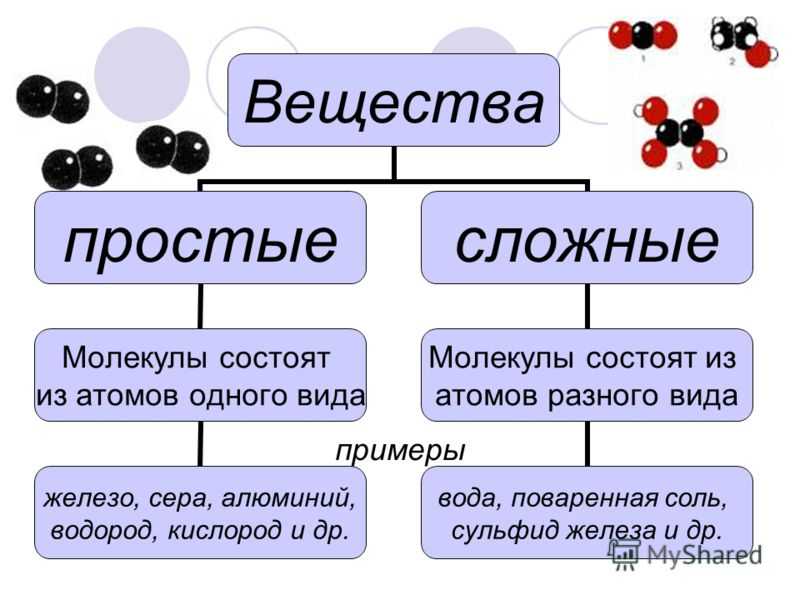
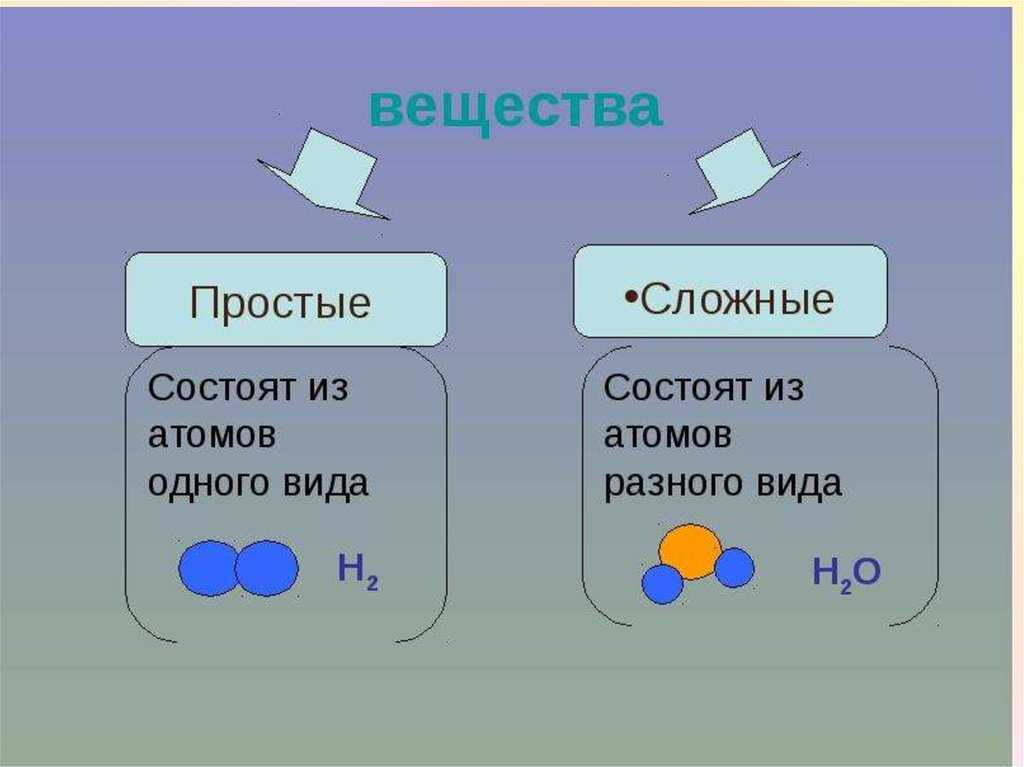
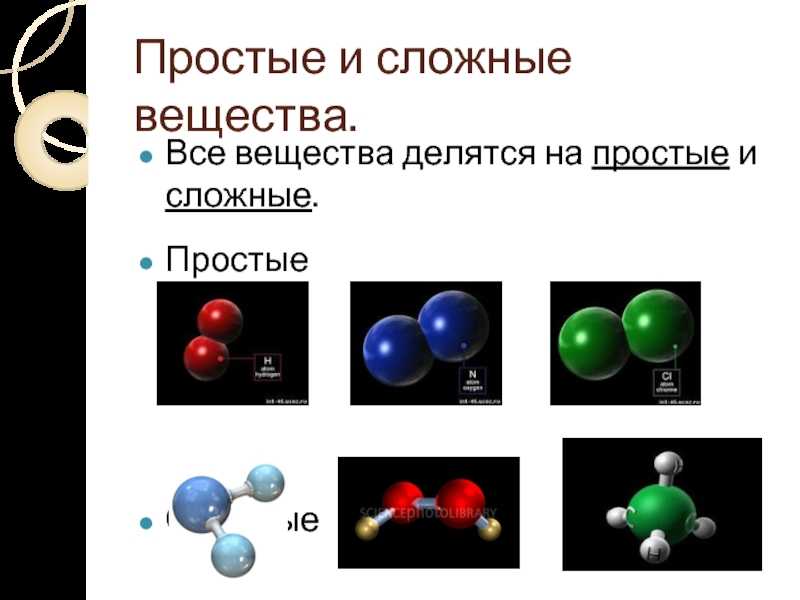
Простые вещества – вещества, в состав которых входят атомы одного вида
К простым веществам, из числа известных вам веществ, относят: кислород, графит, серу, азот, все металлы: железо, медь, алюминий, золото и т.д. Сера состоит только из атомов химического элемента серы, а графит состоит из атомов химического элемента углерода. Нужно четко различать понятия «химический элемент» и «простое вещество».
Например, алмаз и углерод – не одно и тоже.
Углерод – химический элемент, а алмаз – простое вещество, образованное химическим элементов углеродом. В данном случае химический элемент (углерод) и простое вещество (алмаз) называются по-разному.
Часто химический элемент и отвечающее ему простое вещество называются одинаково. Например, элементу кислороду, соответствует простое вещество – кислород. Различать, где идет речь об элементе, а где о веществе, необходимо научиться! Например, когда говорят, что кислород входит в состав воды – речь идет об элементе кислороде. Когда говорят, что кислород – это газ, необходимый для дыхания – здесь идет речь о простом веществе кислороде. Простые вещества химических элементов подразделяют на две группы – металлы и неметаллы.
Металлы и неметаллы кардинально отличаются по своим физическим свойствам. Все металлы при нормальных условиях твердые вещества, исключение составляет ртуть – единственный жидкий металл.
Металлы непрозрачны, обладают характерным металлическим блеском. Металлы пластичны, хорошо проводят тепло и электрический ток.Неметаллы не похожи друг на друга по физическим свойствам. Так, водород, кислород, азот – газы, кремний, сера, фосфор – твердые вещества. Единственный жидкий неметалл – бром – жидкость коричнево-красного цвета.Если провести условную линию от химического элемента бора к химическому элементу астату, то в длинном варианте
Периодической Системы над линией расположены неметаллические элементы, а под ней – металлические. В коротком варианте Периодической Системы под этой линией расположены неметаллические элементы, а над ней – как металлические, так и неметаллические элементы. Значит, определять, является элемент металлическим или неметаллическим, удобнее по длинному варианту Периодической Системы.
Это деление условное, поскольку все элементы так или иначе проявляют как металлические, так и неметаллические свойства, но в большинстве случаев такое распределение соответствует действительности.
Сложные вещества
224
Практически все сложные вещества имеют молекулярную кристаллическую решетку. Но есть исключения, при которых для сложных веществ характерна атомная кристаллическая решетка. Например, соединения, содержащие оксид кремния, имеют атомную кристаллическую решетку.
Иногда встречаются сложные вещества с ионной кристаллической решеткой. В узлах таких решеток одновременно находятся положительно и отрицательно заряженные ионы. Например, у поваренной соли ионная решетка.
Не все сложные вещества в условиях лаборатории могут разлагаться на простые вещества. Например, из атомов железа и серы образован сульфид железа, который не разлагается в лабораторных условиях. То, что сульфид железа – сложное вещество, можно доказать опытным путем.
Чтобы получить сульфид железа, необходимо смешать железные опилки с порошком серы в массовых отношениях 7:4 соответственно. Действуя на полученную смесь магнитом и помещая смесь в сосуд с водой, убеждаются, что железо и сера в смеси сохраняют свои свойства (железо притягивается к магниту, а сера – нет). Сера в воде всплывает, а железо опускается на дно. После этого смесь помещают в пробирку и нагревают до начала химической реакции. Затем нагревание прекращают и дают пробирке остыть. Содержимое пробирки измельчают в ступке, а после приливают воду и проводят над веществом магнитом. Убеждаются, что в полученном веществе железо от серы невозможно отделить ни магнитом, ни с помощью воды. Таким образом, в результате взаимодействия серы и железа образовалось сложное вещество – сульфид железа.
Различие между атомами
Атом представляет собой связанную электрическими силами систему из ядра и электронного облака. Ядро образовано протонами и нейтронами и имеет положительный электрический заряд, складывающийся из зарядов протонов. Нейтроны, не имеющие заряда, вносят вклад в массу ядра и, соответственно, атома.
Мельчайшие носители отрицательного заряда – электроны – образуют вокруг ядра облако. Зарядом ядра определяется их число, от которого зависит конфигурация облака, – в частности, заполнение электронами его внешней оболочки, то есть химические свойства атома. Разнообразие атомов – это следствие существования ядер с разным количеством протонов.
Полимеры
Некоторые химические соединения — вещество в веществе: они состоят из звеньев, повторенных много раз, в результате чего получается своего рода нитка бус. Такие вещества называются полимерами. Некоторые вам хорошо знакомы: полиэтилен, из которого сделаны магазинные пакеты, поливинилхлорид (ПВХ) «виниловых» пластинок, полистирольные контейнеры, в которых продают еду на вынос, — про эти сразу все понятно. Однако есть и менее очевидные полимеры — нейлон и шелк, а также ДНК и белки мышц: все это — полимеры. Повторяющееся звено во всех полимерах, и природных, и искусственных, называется мономером. Много соединенных между собой мономеров — полимер. Нейлон особенно показателен: в любой школьной лаборатории можно увидеть эксперимент, когда из пробирки вытягивают нейлоновое волокно — хоть на катушку наматывай, как обычную нитку.
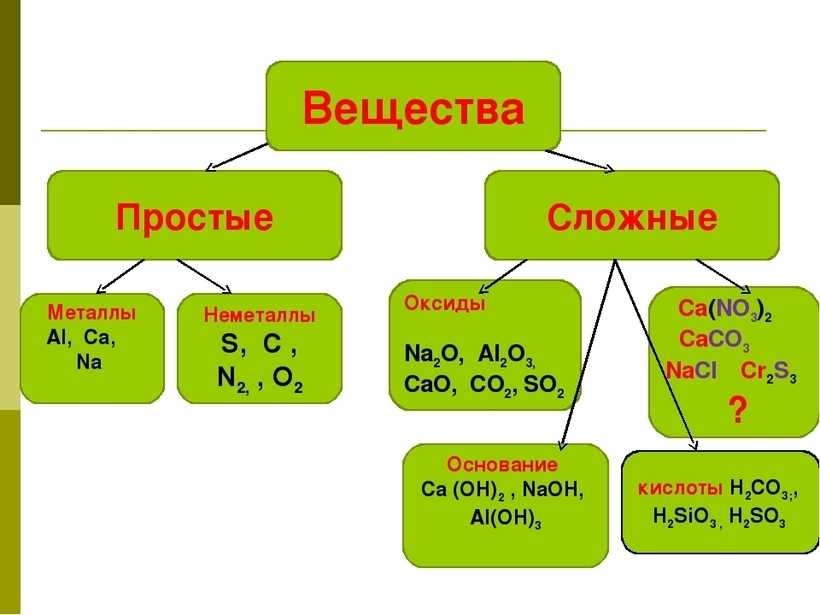
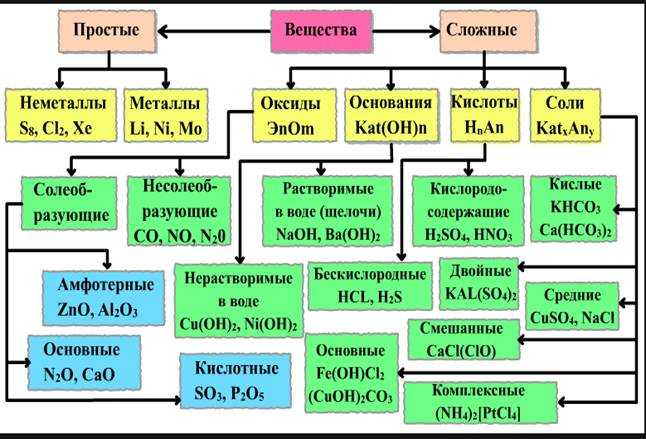
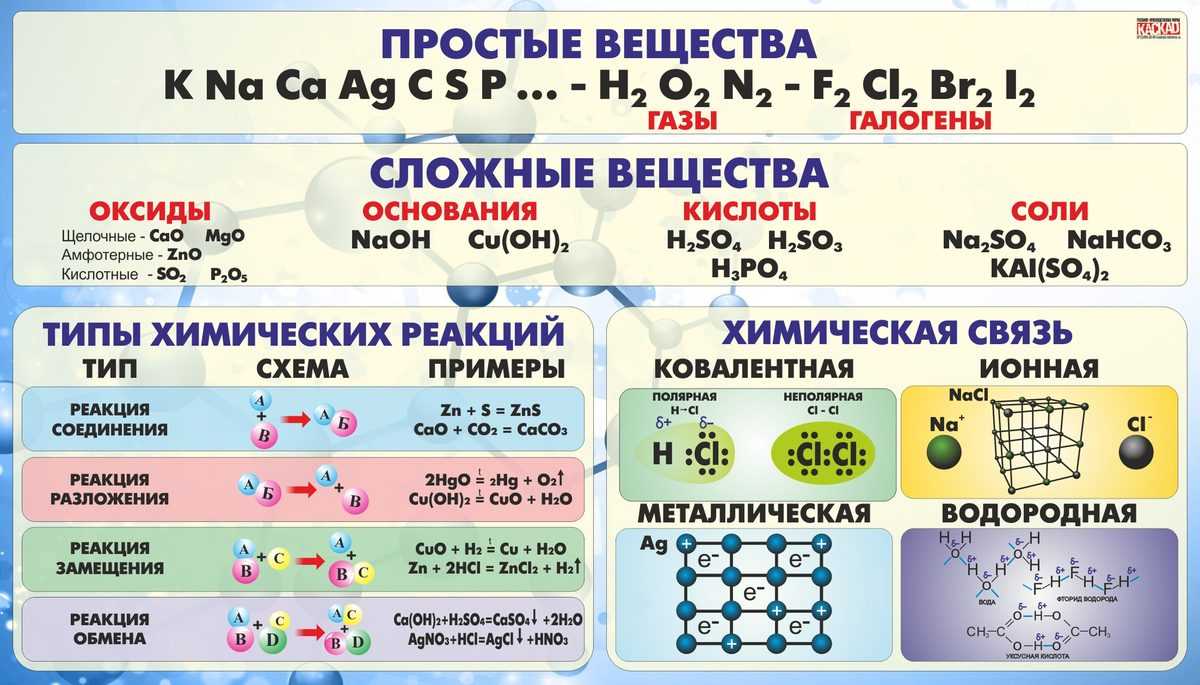
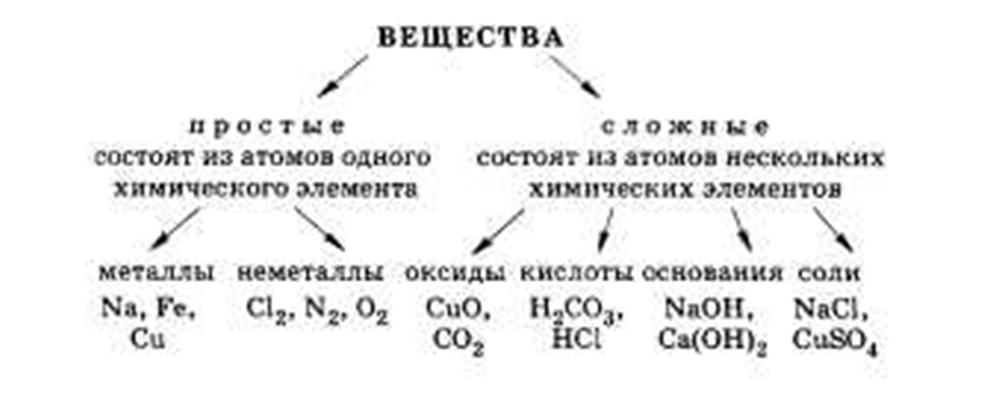
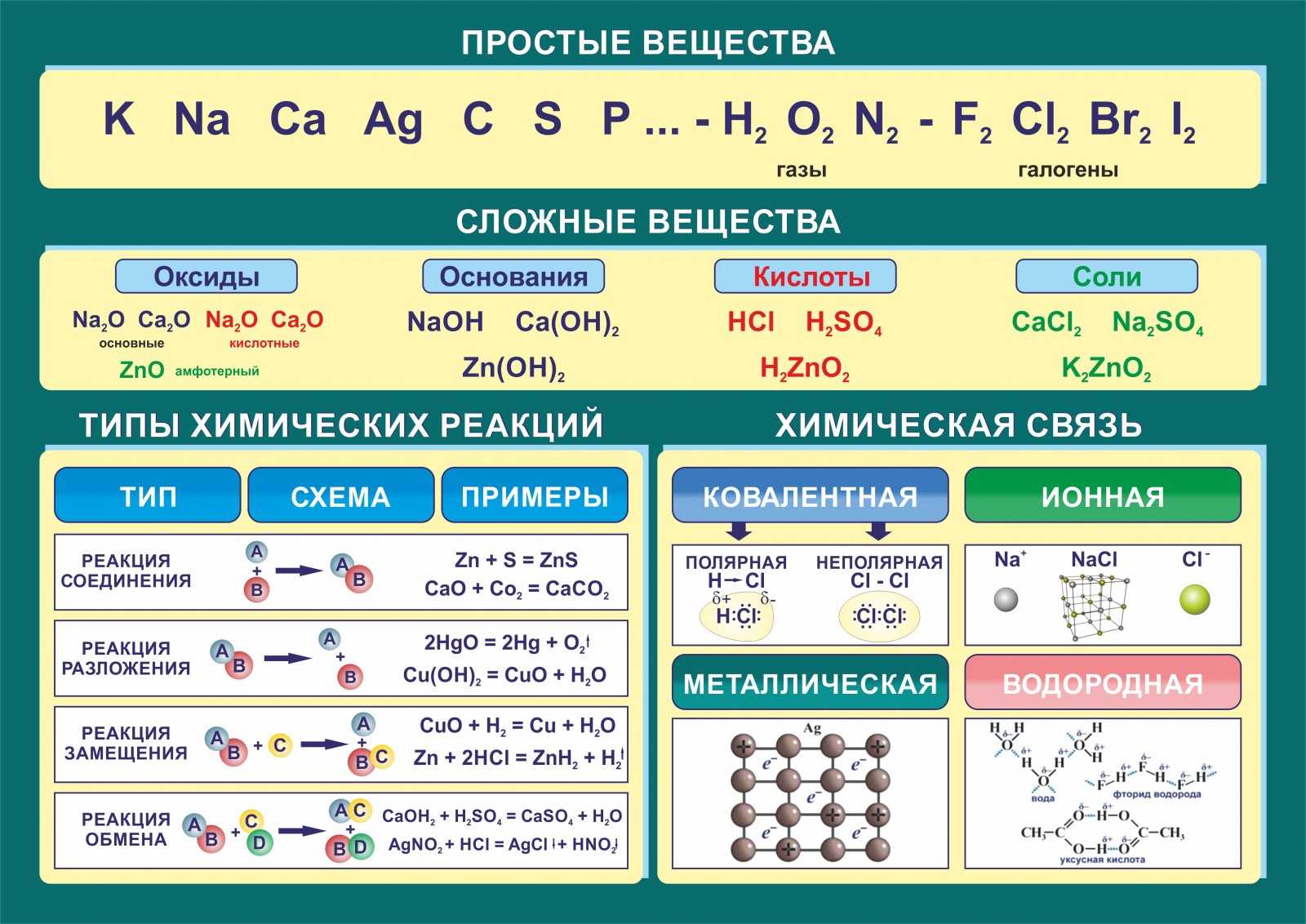
Классификация неорганических веществ
Неорганические вещества
по составу делят напростые и сложные .
Простые вещества
состоят из атомов одного химического элемента и подразделяются на металлы, неметаллы, благородные газы. Сложные вещества состоят из атомов разных элементов, химически связанных друг с другом.
Сложные неорганические вещества по составу и свойствам распределяют по следующим важнейшим классам: оксиды, основания, кислоты, амфотерные гидроксиды, соли.
- Оксиды — это сложные вещества, состоящие из двух химических элементов, один из которых — кислород со степенью окисления (—2). Общая формула оксидов: ЭmОn, где m — число атомов элемента Э, а n — число атомов кислорода. Оксиды, в свою очередь, классифицируют на солеобразующие и несолеобрадующие. Солеобразующие делятся на основные, амфотерные, кислотные, которым соответствуют основания, амфотерные гидроксиды, кислоты соответственно.
- Основные оксиды — это оксиды металлов в степенях окисления +1 и +2. К ним относятся: оксиды металлов главной подгруппы первой группы (щелочные металлы )Li — Fr
- оксиды металлов главной подгруппы второй группы (Mg и щелочноземельные металлы )Mg — Ra
- оксиды переходных металлов в низших степенях окисления
Кислотные оксиды —образуют неметаллы со С.О. более +2 и металлы со С.О. от +5 до +7 (SO2, SeO2, Р2O5, As2O3, СO2, SiO2, CrO3 и Mn2O7).Исключение: у оксидов NO2и ClO2нет соответствующих кислотных гидроксидов, но их считают кислотными.
Амфотерные оксиды — образованы амфотерными металлами со С.О. +2, +3,+4 (BeO, Cr2O3, ZnO, Al2O3, GeO2, SnO2 и РЬО).
Несолеобразующие оксиды — оксиды неметаллов со С.О.+1, +2 (СО, NO, N2O, SiO).
Основания — это сложные вещества, состоящие из атомов металла и одной или нескольких гидроксогрупп (-ОН). Общая формула оснований: М(ОН)у, где у — число гидроксогрупп, равное степени окислении металла М (как правило, +1 и +2). Основания делятся на растворимые (щелочи) и нерастворимые.
Кислоты — (кислотные гидроксиды) — это сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металла, и кислотных остатков. Общая формула кислот: НхАс, где Ас — кислотный остаток (от английского «acid» — кислота), х — число атомов водорода, равное заряду иона кислотного остатка.
Амфотерные гидроксиды — это сложные вещества, которые проявляют и свойства кислот, и свойства оснований. Поэтому формулы амфотерных гидроксидов можно записывать и в форме кислот, и в форме оснований.
Соли — это сложные вещества, состоящие из катионов металла и анионов кислотных остатков. Такое определение относится к средним солям.
Средние соли — это продукты полного замещения атомов водорода в молекуле кислоты атомами металла или полного замещения гидроксогрупп в молекуле основания кислотными остатками.
Кислые соли — атомы водорода в кислоте замещены атомами металла частично. Они получаются при нейтрализации основания избытком кислоты. Чтобы правильно назватькислую соль, необходимо к названию нормальной соли прибавить приставку гидро- или дигидро- в зависимости от числа атомов водорода, входящих в состав кислой соли.Например, KHCO3 – гидрокарбонат калия, КH2PO4 – дигидроортофосфат калия. Нужно помнить, что кислые соли могут образовывать только двух и более основные кислоты.
Осно́вные соли — гидроксогруппы основания (OH−) частично замещены кислотными остатками. Чтобы назватьосновную соль, необходимо к названию нормальной соли прибавить приставку гидроксо- или дигидроксо- в зависимости от числа ОН – групп, входящих в состав соли.Например, (CuOH)2CO3 – гидроксокарбонат меди (II).Нужно помнить, что основные соли способны образовывать лишь основания, содержащие в своём составе две и более гидроксогрупп.
Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами. Например, KAl(SO4)2, KNaSO4.
Смешанные соли — в их составе присутствует два различных аниона. Например, Ca(OCl)Cl.
Гидратные соли (кристаллогидраты ) — в их состав входят молекулы кристаллизационной воды. Пример: Na2SO4 ·10H2O.
Классификация неорганических соединений
Названия кислот и кислотных остатков
| Кислота | Кислотный остаток | ||
| Название | Формула | Название | Формула |
|
Соляная (хлороводородная) |
HCl | Хлорид | Cl(-) |
|
Плавиковая (фтороводородная) |
HF | Фторид | F(-) |
| Бромоводородная | HBr | Бромид | Br(-) |
| Иодоводородная | HI | Иодид | I(-) |
| Азотистая | HNO2 | Нитрит | NO2(-) |
| Азотная | HNO3 | Нитрат | NO3(-) |
| Сероводородная | H2S |
Сульфид Гидросульфид |
S(2-)HS(-) |
| Сернистая | H2SO3 |
Сульфит Гидросульфит |
SO3(2-)HSO3(-) |
| Серная | H2SO4 |
Сульфат Гидросульфат |
SO4(2-)HSO4(-) |
| Угольная | H2CO3 |
Карбонат Гидрокарбонат |
СО3(2-)НСО3(-) |
| Кремниевая | H2SiO3 | Силикат | SiO3(2-) |
| Ортофосфорная | H3PO4 |
Ортофосфат Гидроортофосфат Дигидроортофосфат |
РО4(3-)НРО4(2-)Н2РО4(-) |
| Муравьиная | НСООН | Формиат | НСОО(-) |
| Уксусная | СН3СООН | Ацетат | СН3СОО(-) |
Простое и сложное химическое вещество
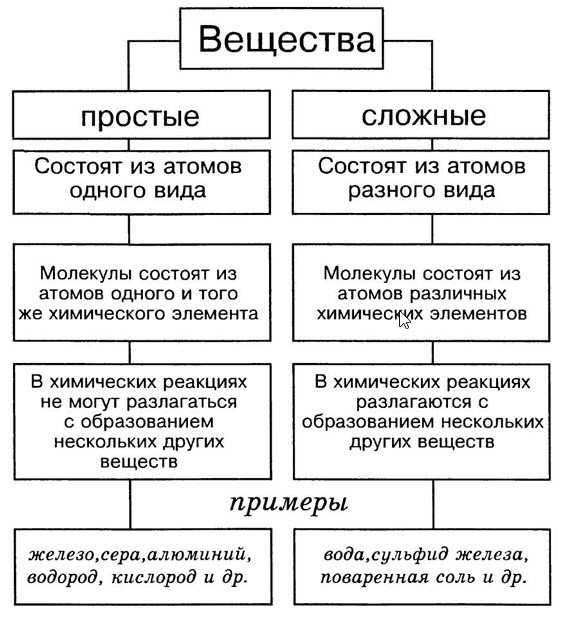
Простые вещества
Простым называют вещество, состоящее из однотипных атомов, то есть образованное одним элементом. Его нельзя разложить на другие вещества.
Простые вещества подразделяют на две группы:
- металлы: натрий, алюминий, марганец, золото, железо и т. д.;
- неметаллы: кислород, озон, водород, хлор, графит и пр.
Если атомы связаны в молекулы, то простое вещество считается соединением (бром, фосфор, большинство газов). В отличие от них, металлы, алмаз, графит, инертные газы – это атомарные вещества.
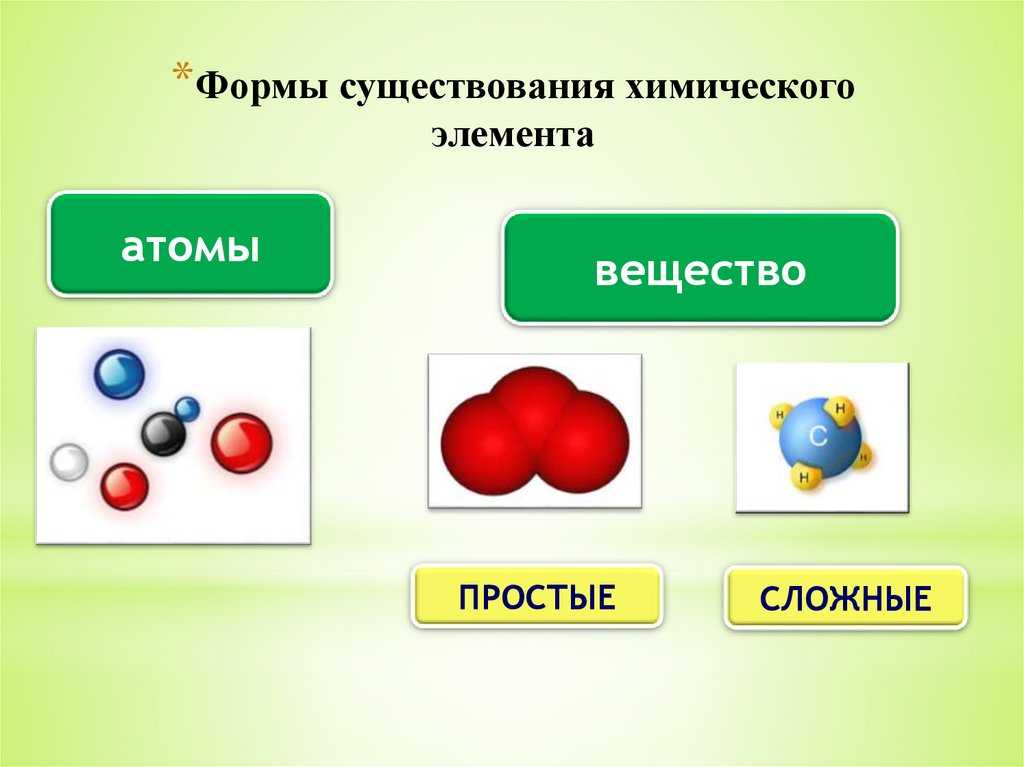
Элемент и вещество
Понятие простого вещества необходимо отличать от понятия химического элемента. Элемент – это совокупность химически одинаковых атомов. В свободном виде он существует в форме природного или искусственного простого вещества.
| Химические элементы | Простые вещества | |
| Характеристики | Атомный номер
Относительная атомная масса Распространенность Изотопный состав Валентность Химический символ |
Физические свойства (магнитные, оптические, термические и пр.)
Молярная масса Растворимость Токсичность Химическая формула |
| Примеры высказываний | Относительная атомная масса хлора равна 35,5
Азот входит в состав многих соединений |
Молекула хлора имеет относительную массу 71
Азот входит в состав атмосферы |
Аллотропия
Некоторые элементы в свободном виде существуют в нескольких формах. Это явление называется аллотропией. Различным формам одного элемента – аллотропным модификациям – присущи разные свойства. Аллотропия обусловлена следующими причинами:
- Различия в составе. Например, вещества кислород (O2) и озон (O3) – аллотропные модификации химического элемента кислород.
- Различия в строении. Элемент углерод представлен такими веществами, как алмаз, графит, графен, фуллерены. Различают аморфный и кристаллический кремний, белый, красный, черный и другие виды фосфора.
Число химических элементов достигло 118, но вследствие аллотропии простых веществ насчитывается свыше 400.
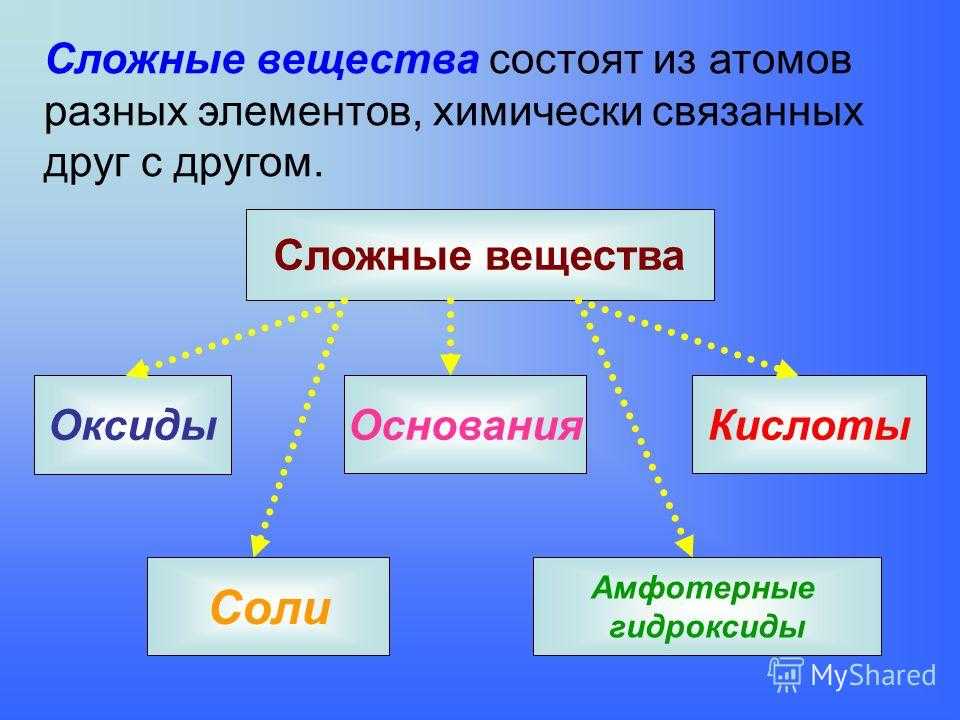
Сложные вещества
Сложное вещество построено из химически связанных атомов различных элементов. Получение и разложение сложных веществ осуществляется в химических реакциях. Это отличает их от смесей.
- Неметаллы, как правило, образуют вещества, состоящие из молекул: воду H2O, аммиак NH3, углекислый газ CO2, метан CH4.
- Металлы образуют немолекулярные соединения: поваренную соль NaCl, негашеную известь CaO, гидрид меди CuH.
Классификация сложных химических веществ
Исходя из строения и свойств, выделяют следующие классы сложных соединений:
- Бинарные. Это вещества, образованные двумя элементами: гидриды (CaH2, KH), карбиды (SiC, Mg2C) бескислородные кислоты (соляная HCl, сероводород H2S) и их соли (хлориды, сульфиды и др.).
- Оксиды. Это сложные бинарные вещества, в составе которых есть кислород со степенью окисления (условным зарядом иона) -2. Различают основные K2O, MgO (степень окисления металла +1, +2), кислотные SO3, CO2, CrO3 с неметаллами или металлами в степени окисления от +5 до +7, амфотерные ZnO, Al2O3 и несолеобразующие (CO, SiO, NO и N2O) оксиды.
- Гидроксиды характеризуются составом вида «элемент – группа OH». К этому классу веществ относят:
- Кислоты (азотная HNO3, фосфорная H3PO4, серная H2SO4). Образуются в результате взаимодействия кислотных оксидов с водой. Имеют в составе один или несколько атомов водорода, которые могут замещаться атомом металла, и кислотный остаток.
- Основания (едкий натр NaOH, гашеная известь Ca(OH)2), образующиеся в реакциях воды с основными оксидами. Растворимые основания (KOH, NaOH) называются щелочами.
- Амфотерные гидроксиды способны проявлять и кислотные, и основные свойства.
- Соли. Это сложные химические вещества с составом типа «металл – кислотный остаток». Соль – продукт реакции между кислотой и основанием. Карбонат калия (поташ) K2(CO)3, сульфат меди (медный купорос) CuSO4 – примеры солей.

| Наименования некоторых кислот, кислотных остатков и солей | |||||
| Кислота | Кислотный остаток | Соль | |||
| Азотная | HNO3 | нитрат | NO3 | нитрат натрия | NaNO3 |
| Азотистая | HNO2 | нитрит | NO2 | нитрит кальция | Ca(NO2)2 |
| Серная | H2SO4 | сульфат | SO4 | сульфат алюминия | Al2(SO4)3 |
| Сернистая | H2SO3 | сульфит | SO3 | сульфит калия | K2SO3 |
| Угольная | H2CO3 | карбонат | CO3 | карбонат кальция | CaCO3 |
| Хлорная | HClO4 | перхлорат | ClO4 | перхлорат серебра | AgClO4 |
| Хлорноватая | HClO3 | хлорат | ClO3 | хлорат меди | Cu(ClO3)2 |
| Кремниевая (метакремниевая) | H2SiO3 | силикат (метасиликат) | SiO3 | метасиликат лития | Li2SiO3 |
| Уксусная | CH3COOH | ацетат | CH3COO | ацетат натрия | CH3COONa |
| Марганцовая | HMnO4 | перманганат | MnO4 | перманганат калия | KMnO4 |
| Муравьиная | HCOOH | формиат | HCOO | формиат калия | HCOOK |
Количество сложных веществ, включая полученные искусственно соединения, превышает 25 миллионов.
Химические элементы и их соединения
Совокупность атомов с одинаковой величиной заряда ядра называют химическим элементом. Эта величина в периодической таблице представлена порядковым номером элемента. Например, номер азота – 7 – означает, что в ядре атома азота 7 протонов.
У химических элементов существуют разновидности – изотопы, отличающиеся числом нейтронов в ядре и значениями атомных масс. Физические свойства изотопов неодинаковы, а химические идентичны, поскольку они представляют один и тот же элемент.
Число внешних электронов в атоме может изменяться. В этом случае он приобретает электрический заряд и становится ионом: отрицательным, если присоединяет лишний электрон, и положительным при потере своего. При этом не происходит превращения одного химического элемента в другой, так как заряд ядра сохраняется.
Соединения. Химические формулы
Атомы вступают в химическую связь, взаимодействуя внешними электронными оболочками, и образуют молекулы или немолекулярные структуры с регулярным строением. Вещества, частицы которых представляют собой устойчивые сочетания атомов или ионов, называются химическими соединениями.
Химические обозначения соединений – формулы – отражают элементный состав и количество атомов каждого элемента в структурной единице вещества. Формула H2 означает, что молекула вещества образована одним элементом и состоит из двух атомов. По формуле KNO3 видно, что вещество составлено тремя элементами – калием, азотом и кислородом в соотношении 1:1:3.