Простые неорганические соединения: металлы
Металлы – простые вещества, соединение атомов которых основывается на металлической связи. Эти элементы имеют характерные металлические свойства: теплопроводность, электропроводность, пластичность, блеск и другие. Всего в этой группе выделяют 96 элементов. К ним относятся:
- щелочные металлы: литий, натрий, калий;
- щелочноземельные металлы: магний, стронций, кальций; медь, серебро, золото;
- легкие металлы: алюминий, олово, свинец;
- полуметаллы: полоний, московий, нихоний;
- лантаноиды и лантан: скандий, иттрий;
- актиноиды и актиний: уран, нептуний, плутоний.
В основном в природе металлы встречаются в виде руды и соединений. Чтобы получить чистый металл без примесей, проводится его очистка. При необходимости возможно проведение легирования или другой обработки. Этим занимается специальная наука – металлургия. Она подразделяется на черную и цветную.
Почему углерод?
Действительно, отчего из более, чем сотни химических элементов, только углерод оказался способным образовать миллионы веществ? Основных причин две: атомы углерода способны соединяться со атомами множества других элементов (водорода, кислорода, азота, серы, фосфора и многих других) и друг с другом. В последнем случае образуются цепочки какой угодно длины и самой разнообразной конструкции – линейные, разветвлённые, замкнутые.
В результате число природных и синтезированных органических веществ исчисляется примерно 27 миллионами, а неорганических приближается всего лишь к полумиллиону. Как говорится, почувствуйте разницу.
Описание
Неорганическими называются такие вещества, в составе которых нет углерода. Они противоположны органическим. Также к этой группе относят несколько углеродосодержащих соединений, например:
- цианиды;
- оксиды углерода;
- карбонаты;
- карбиды и другие.
Примеры неорганических веществ:
- вода;
- разные кислоты (соляная, азотная, серная);
- соль;
- аммиак;
- углекислый газ;
- металлы и неметаллы.
Неорганическая группа отличается отсутствием углеродного скелета, который характерен для органических веществ. Неорганические вещества по составу принято делить на простые и сложные. Простые вещества составляют немногочисленную группу. Всего их насчитывается примерно 400.
Применение органических веществ
Органические вещества – это класс химических соединений, объединяющий все вещества, в состав которых входит углерод.
Предельные (насыщенные) углеводороды, атомами водорода: СН4 – метан (основа природного газа), С2Н6 – этан, С3Н8 – пропан, С8Н18 – октан (основа бензина).
Широко распространено применение данной группы органических соединений в химической промышленности (для производства пластмасс, синтетических волокон и т.д.) и медицине.
Соединения служат исходными веществами для получения ряда готовых продуктов:
- растворителей (спиртов, дихлорэтана, эфира);
- полимеров (полиэтилена, поливинилхлорида, полиизобутилена);
Этилен (Н2С=С Н2) используется для получения, тефлона, этилового спирта, уксусного альдегида, галогенопроизводных и многих других органических соединений.
Алкены применяются и для ускорения процесс созревания фруктов.
Алкины (ацетиленовые углеводороды)
Ацетилен – необходим в качестве исходного продукта в органическом синтезе при производстве:
- полимеров (каучука, поливинилхлорида и др.);
- растворителей (1,1,2,2-тетрахлорэтана , 1,1,2-трихлорэтена);
- уксусной кислоты.
Температура пламени вещества достигает 3150°С, что нашло свое применение при резке металла и в сварке.
Алкоголи – производные углеводородов, в которых один или несколько атомов водорода замещены на гидроксильную группу ОН.
Метанол (СН3ОН) –применяется в производстве муравьиной кислоты и формальдегида. Рассматривается как вариант для применения в качестве моторного топлива.
Этанол (С2Н5ОН)- востребован в виде исходного соединения для получения уксусной кислоты, сложных эфиров, карбоновых кислот. Вещество служит основой производства спиртосодержащей продукции и антисептических средств.
Этиленгликоль – компонент необходимый в производстве пластмасс, антифризов, органическом синтезе.
Глицерин – незаменим в разных отраслях промышленности, в том числе текстильной, пищевой, фармакологии.
Основное использование соединений приходится на химическую промышленность, медицину (производство синтетических смол, красителей, антисептиков, взрывчатых веществ и т.д.).
Метаналь – используется при получении фенолформальдегидных и карбамидных смол, синтезе лекарственных средств, как дезинфицирующее средство.
Этаналь — нашел свое применение в органическом синтезе.
Карбоновые кислоты
Соединения, карбоксильной группы –СООН.
Муравьиная кислота (НСООН) –применяется в фармацевтической и пищевой промышленности. Уксусная кислота (СН3СООН) — востребована для производства искусственных волокон на основе целлюлозы и в пищевой промышленности.
Бензойная кислота (С6Н5СООН) – незаменима в фармацевтике для синтеза душистых веществ и красителей, а также в качестве консерванта для пищевых продуктов.
Сложные эфиры
Применяются в пищевой и парфюмерной отраслях в качестве отдушек. А также обеспечивают эластичность и пластичность пластмасс и резины.
Также широко распространено в пищевой промышленности, медицине применение глюкозы, аминов, аминокислот. Целлюлоза основной компонент при изготовлении бумаги, пленок, искусственных волокон и т.д.
Много соединений еще не изучено до конца, и возможно, благодаря науке человек сможет заменить натуральные продукты на искусственные, органических соединений природного происхождения применяется все меньше.
-
Доклад про святую екатерину
-
Социалистическая правовая семья доклад
-
Умения и навыки доклад
-
Доклад военнослужащего начальнику о происшествии
- Доклад на тему гироскопический датчик
Что такое сложные вещества
Сложные вещества — это вещества, образованные атомами нескольких химических элементов.
Например, молекула HNO3 состоит из одного атома водорода, одного атома азота и трех атомов кислорода.
К сложным веществам в химии относятся две большие группы веществ: неорганические и органические.
Неорганические вещества
Неорганические вещества делятся на 4 вида:
-
Оксиды — вещества, молекулы которых состоят из двух химических элементов, один из которых — кислород в степени окисления −2.
Например: Na2O, CaO, P2O5.
-
Основания — вещества, молекулы которых состоят из катиона металла и гидроксильной группы (—OH).
Например: KOH, Fe(OH)3, Ni(OH)2.
-
Кислоты — вещества, молекулы которых состоят из катиона водорода (H+), способного замещаться атомом металла, и кислотного остатка.
Например: HNO3, HCl, H3PO4.
-
Соли — вещества, состоящие из катиона металла и кислотного остатка.
Например: NaCl, CaCO3, K2SO4.
Кратко о классификации веществ можно узнать из схемы:
Номенклатура неорганических веществ
Названия простых веществ чаще всего совпадают с названием химического элемента, а для сложных веществ существует два вида номенклатуры: тривиальная и систематическая.
В тривиальной номенклатуре вещества названы в соответствии с их особенностями, например специфическим запахом или окраской.
В систематической номенклатуре название зависит от вида неорганического вещества.
Оксиды
Напоминаем
Если степень окисления у элемента постоянная, то она в конце названия не указывается.
Примеры названий оксидов:
-
Fe2O3 — оксид железа (III). Читается: феррум два о три;
-
Na2O — оксид натрия. Читается: натрий два о.
Основания
Примеры названий гидроксидов:
-
Fe(OH)3 — гидроксид железа (III). Читается: феррум о аш трижды;
-
NaOH — гидроксид натрия. Читается: натрий о аш.
Соли
Примеры названий солей:
-
KNO3 — нитрат калия. Читается: калий эн о три;
-
AlCl3 — хлорид алюминия. Читается: алюминий хлор три.
Кислоты
Названия кислот, кислотных остатков и их формулы необходимо выучить, они приведены в таблице ниже.
Органические и неорганические вещества – в чем разница
![]()
- Органические более известны и исследованы в науке.
- Органических веществ в мире числится намного больше. Количество известных науке органических – около миллиона, неорганических – сотни тысяч.
- Большинство органических соединений связаны между собой с помощью ковалентного характера соединения, связь неорганических между собой возможна с помощью ионного соединения.
- Присутствует отличие и по составу входящих элементов. Органические вещества составляют углеродные, водородные, кислородные, реже – азотные, фосфорные, серные и галогенные элементы. Неорганические – состоят из всех элементов таблицы Менделеева, кроме углерода и водорода.
- Органические вещества намного значительнее поддаются влиянию горячих температур, могут разрушаться даже при незначительных температурах. Большинство неорганических менее предрасположены к воздействию сильного нагревания из-за особенностей типа молекулярного соединения.
- Органические вещества являются составляющими элементами живой части мира (биосферы), неорганические – неживой (гидросферы, литосферы и атмосферы).
- Состав органических веществ является по своему строению сложнее, чем состав неорганических.
- Органические вещества отличаются большим разнообразием возможностей химических превращений и реакций.
- Из-за ковалентного типа связи между органическими соединениями химические реакции по времени продолжаются несколько дольше, чем химические реакции в неорганических соединениях.
- Неорганические вещества не могут быть продуктом питания живых существ, даже более того – некоторые из этого типа сочетаний могут быть смертельно опасны для живого организма. Органические вещества являются продуктом, произведенным живой природой, а также элементом строения живых организмов.
https://youtube.com/watch?v=GItX7MHXf8w
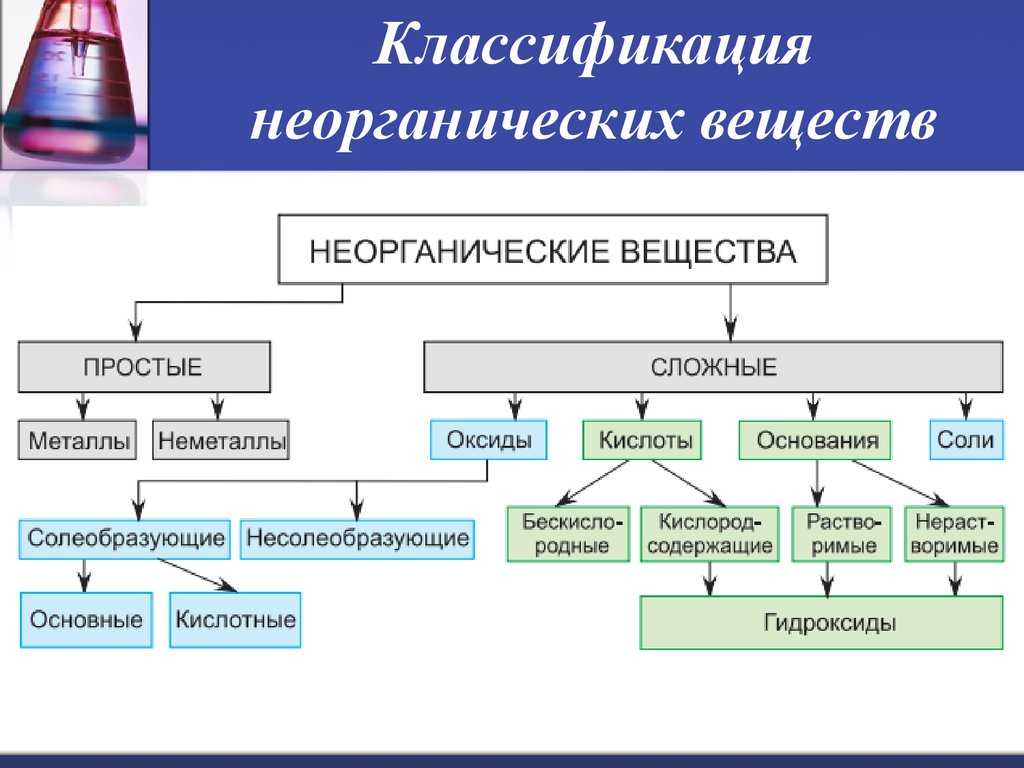
Классификация неорганических веществ
Неорганические вещества
по составу делят напростые и сложные .
Простые вещества
состоят из атомов одного химического элемента и подразделяются на металлы, неметаллы, благородные газы. Сложные вещества состоят из атомов разных элементов, химически связанных друг с другом.
Сложные неорганические вещества по составу и свойствам распределяют по следующим важнейшим классам: оксиды, основания, кислоты, амфотерные гидроксиды, соли.
- Оксиды — это сложные вещества, состоящие из двух химических элементов, один из которых — кислород со степенью окисления (—2). Общая формула оксидов: ЭmОn, где m — число атомов элемента Э, а n — число атомов кислорода. Оксиды, в свою очередь, классифицируют на солеобразующие и несолеобрадующие. Солеобразующие делятся на основные, амфотерные, кислотные, которым соответствуют основания, амфотерные гидроксиды, кислоты соответственно.
- Основные оксиды — это оксиды металлов в степенях окисления +1 и +2. К ним относятся: оксиды металлов главной подгруппы первой группы (щелочные металлы )Li — Fr
- оксиды металлов главной подгруппы второй группы (Mg и щелочноземельные металлы )Mg — Ra
- оксиды переходных металлов в низших степенях окисления
Кислотные оксиды —образуют неметаллы со С.О. более +2 и металлы со С.О. от +5 до +7 (SO2, SeO2, Р2O5, As2O3, СO2, SiO2, CrO3 и Mn2O7).Исключение: у оксидов NO2и ClO2нет соответствующих кислотных гидроксидов, но их считают кислотными.
Амфотерные оксиды — образованы амфотерными металлами со С.О. +2, +3,+4 (BeO, Cr2O3, ZnO, Al2O3, GeO2, SnO2 и РЬО).
Несолеобразующие оксиды — оксиды неметаллов со С.О.+1, +2 (СО, NO, N2O, SiO).
Основания — это сложные вещества, состоящие из атомов металла и одной или нескольких гидроксогрупп (-ОН). Общая формула оснований: М(ОН)у, где у — число гидроксогрупп, равное степени окислении металла М (как правило, +1 и +2). Основания делятся на растворимые (щелочи) и нерастворимые.
Кислоты — (кислотные гидроксиды) — это сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металла, и кислотных остатков. Общая формула кислот: НхАс, где Ас — кислотный остаток (от английского «acid» — кислота), х — число атомов водорода, равное заряду иона кислотного остатка.
Амфотерные гидроксиды — это сложные вещества, которые проявляют и свойства кислот, и свойства оснований. Поэтому формулы амфотерных гидроксидов можно записывать и в форме кислот, и в форме оснований.
Соли — это сложные вещества, состоящие из катионов металла и анионов кислотных остатков. Такое определение относится к средним солям.
Средние соли — это продукты полного замещения атомов водорода в молекуле кислоты атомами металла или полного замещения гидроксогрупп в молекуле основания кислотными остатками.
Кислые соли — атомы водорода в кислоте замещены атомами металла частично. Они получаются при нейтрализации основания избытком кислоты. Чтобы правильно назватькислую соль, необходимо к названию нормальной соли прибавить приставку гидро- или дигидро- в зависимости от числа атомов водорода, входящих в состав кислой соли.Например, KHCO3 – гидрокарбонат калия, КH2PO4 – дигидроортофосфат калия. Нужно помнить, что кислые соли могут образовывать только двух и более основные кислоты.
Осно́вные соли — гидроксогруппы основания (OH−) частично замещены кислотными остатками. Чтобы назватьосновную соль, необходимо к названию нормальной соли прибавить приставку гидроксо- или дигидроксо- в зависимости от числа ОН – групп, входящих в состав соли.Например, (CuOH)2CO3 – гидроксокарбонат меди (II).Нужно помнить, что основные соли способны образовывать лишь основания, содержащие в своём составе две и более гидроксогрупп.
Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами. Например, KAl(SO4)2, KNaSO4.
Смешанные соли — в их составе присутствует два различных аниона. Например, Ca(OCl)Cl.
Гидратные соли (кристаллогидраты ) — в их состав входят молекулы кристаллизационной воды. Пример: Na2SO4 ·10H2O.
Классификация неорганических соединений
Виды неорганических веществ
Неорганические вещества делятся на простые (металлы и неметаллы)
и сложные (оксиды, соли, основания, кислоты).
Простые вещества состоят из атомов одного химического элемента.
По своим химическим свойствам они делятся на:
- металлы (Li, Na, K, Mg, Ca и др.);
- неметаллы (F2, Cl2, O2, S, P и др.);
- амфотерные простые вещества (Zn, Al, Fe, Mn и др.);
- благородные газы (He, Ne, Ar, Kr, Xe, Rn).
Сложные вещества состоят из атомов двух или более химических элементов.
Они по своим химическим свойствам делятся на:
-
оксиды:
- основные оксиды (CaO, Na2O и др.);
- кислотные оксиды (CO2, SO3 и др.);
- амфотерные оксиды (ZnO, Al2O3 и др.);
- двойные оксиды (Fe3O4 и др.);
- несолеобразующие оксиды (CO, NO и др.);
-
гидроксиды:
- основания (NaOH, Ca(OH)2 и др.);
- кислоты (H2SO4, HNO3 и др.);
- амфотерные гидроксиды (Zn(OH)2, Al(OH)3 и др.);
-
соли:
- средние соли (Na2SO4, Ca3(PO4)2 и др.);
- кислые соли (NaHSO3, CaHPO4 и др.);
- основные соли (Cu2CO3(OH)2 и др.);
- двойные и/или комплексные соли (CaMg(CO3)2, K3[Fe(CN)6],
KFeIII[FeII(CN)6] и др.);
-
бинарные соединения:
- бескислородные кислоты (HCl, H2S и др.);
- бескислородные соли (NaCl, CaF2 и др.);
- прочие бинарные соединения (AlH3, CaC2, CS2 и др.).
Существуют и другие сложные вещества:
- карбиды — соединения металлов и неметаллов с углеродом;
-
нитриды — соединения азота с менее электроотрицательными элементами,
например, с металлами (AlN, TiNx, Na3N, Ca3N2, Zn3N2 …)
и с рядом неметаллов (NH3, BN, Si3N4); - гидриды — соединения водорода с металлами и с имеющими меньшую электроотрицательность, чем водород, неметаллами;
- интерметаллиды — Интерметалли?д (интерметаллическое соединение) — химическое соединение из двух или более металлов
- и др.
Основное отличие — органические и неорганические соединения
Органические и неорганические соединения — две широкие категории соединений в химии. Почти все теории, законы и гипотезы в химии сделаны на основе органических и неорганических соединений. Оба типа состоят из вещества в любом физическом состоянии: твердое состояние, жидкое состояние или газообразное состояние. Основное различие между органическими и неорганическими соединениями заключается в том, что органические соединения по существу имеют один или несколько атомов углерода в своей структуре в то время как неорганические соединения могут иметь или не иметь атомы углерода.
Ключевые области покрыты
1. Какие органические соединения — определение, структура, свойства2. Какие неорганические соединения — определение, структура, свойства3. В чем разница между органическими и неорганическими соединениями – Сравнение ключевых различий
Ключевые слова: органические, неорганические, химические, твердые, жидкие, газообразные, ковалентные, ионные, гидрофобность.
Неорганическая и теоретическая химия
Для того чтобы понять, что изучает химия, нужно рассмотреть основные понятия, включенные в этот курс.
Основным теоретическим вопросом, изучаемым в данном разделе, является периодический закон Менделеева. Неорганическая химия в таблицах, представленная в школьном курсе, знакомит юных исследователей с основными классами неорганических веществ, их взаимосвязью. Теория химической связи рассматривает природу связи, ее длину, энергию, полярность. Метод молекулярных орбиталей, валентных связей, теория кристаллического поля – основные вопросы, позволяющие объяснять особенности строения и свойств неорганических веществ.
Химическая термодинамика и кинетика, отвечающие на вопросы, касающиеся изменения энергии системы, описание электронных конфигураций ионов и атомов, их превращение в сложные вещества, базирующиеся на теории сверхпроводимости, дали начало новому разделу – химии полупроводниковых материалов.
![]()
Простые вещества
Простыми называются соединения, состоящие из одного элемента (например, С-углерод, В-бор или Al-аллюминий). Атомы этих веществ соединены металлической или ковалентной связью. Основные классы — это металлы и неметаллы.
Металлы (восстановители)
Металлами называются элементы, обладающие восстановительными свойствами (то есть они стремятся отдавать свои электроны), атомы в составе которых соединяются металлической связью.
Физические признаки:
![]()
- пластичные;
- твердые;
- проводят электричество;
- проводят тепло;
- имеют блеск (поэтому их можно отличить по внешнему виду);
- плавятся и кипят.
Химические свойства проявляются в реакции со следующими веществами:
- неметаллами;
- солями;
- кислотами;
- водой.
При реакции с металлами, которые стоят в ряду активности металлов до алюминия, образуется щелочь и Н₂. При реакции с элементами, которые находятся между алюминием и водородом, образуется оксид металла и Н₂. Реакция со стоящими после водорода металлами не идет.
Неметаллы (окислители)
Неметаллы — это окислители. Какой бы ни была активность вещества, оно стремится принимать электроны. Атомы в соединениях неметаллов связаны ковалентной связью. Основные признаки:
![]()
- Могут иметь 3 агрегатных состояния: газы (водород, кислород, гелий, хлор, азот и другие), жидкости (бром), твердые тела (сера, фосфор, углерод).
- Металлический блеск отсутствует.
- Не проводят электричество (кроме черного фосфора и графита).
- Не проводят тепло (кроме графита).
- Низкая температура кипения.
Химические свойства неметаллов:
- вступают в реакцию с металлами;
- взаимодействуют с неметаллами;
- реагируют со сложными веществами (кислотами, солями, щелочами, оксидами).
Что представляют собой органические вещества?
Такими элементами называют класс химических соединений, которые включают углерод. Исключением считаются карбиды, карбонаты, угольная кислота.
https://youtube.com/watch?v=VJMFq5hzh70
Для органики характерно следующее:
- сравнительно сложное молекулярное строение;
- небольшая температура плавления;
- разлагаемость под влиянием повышенных температур;
- присутствие углерода и водорода в молекулах;
- высокая молекулярная масса;
- биологическое происхождение.
К распространенным элементам относятся белки, липиды, углеводы. В общей сложности современная химическая наука выделяет около 18 миллионов таких соединений. Исследователи считают, что такое разнообразие элементов связано с наличием углерода. Это вещество способно формировать очень широкий спектр связей с другими веществами.
Примеры соединений или молекул
Органикой называются молекулы, которые связаны с живыми организмами. К ним относятся жиры, нуклеиновые кислоты, белки, сахара. Также в эту группу входят ферменты и углеводородное топливо. Перечисленные молекулы включают углерод. Практически все они содержат водород. К тому же многие включают кислород.
К примерам таких составов стоит отнести следующее:
- ДНК;
- сахароза;
- бензол;
- этанол;
- метан.
![]()
Соединения без связей CH
В отдельных органических составах нет углерод-водородных связей. В качестве примера стоит привести следующее:
- мочевина;
- четыреххлористый углерод.
Простые вещества
– это вещества, состоящие из атомов одного элемента.
Подразделяются на две большие группы:
Металлы
Металлы — называется группа простых тел, обладающих известными характерными свойствами, которые в типических представителях резко отличают металлы от других химических элементов.
В физическом отношении это по большей части тела твердые при обыкновенной температуре, непрозрачные (в толстом слое), обладающие известным блеском, ковкие, тягучие, хорошие проводники тепла и электричества и прочее. В химическом отношении для них является характерной способность образовать с кислородом основные окислы, которые, соединяясь с кислотами, дают соли.
К металлам относятся: железо, медь, цинк, кальций, калий, алюминий, золото, серебро, натрий, олово, бериллий и т.д.
Неметаллы
Неметаллами называется группа простых тел, обладающих известными характерными свойствами, которые резко отличают неметаллы от других химических элементов.
В физическом отношении это различные тела твердые: твердые, жидкие и газообразные.
К неметаллам относятся: водород, кислород, азот, фосфор, сера, углерод, аргон, неон и т.д.
Сложные вещества
Вещества, образованные из атомов двух и более химических элементов, называют сложными. Например, каждая молекула воды содержит два атома водорода и один атом кислорода. Ее состав обозначают записью H2O, который читается «аш-два-о».
Другим примером сложных веществ является углекислый газ. Его выдыхают все живые организмы, а растениям он нужен для питания. Молекула углекислого газа образована одним атомом углерода и двумя атомами кислорода. Этот состав молекулы отражают записью СО2, который читается «це о два».
Почему сложных веществ больше, чем простых?
Ученые доказали, что атомы различных химических элементов способны соединяться друг с другом в разном количестве и последовательности. Подобно тому, как в языке сочетанием букв образуется разнообразие слов, сочетанием различных атомов и в разном количестве образовалось более 10000000 веществ. Так что неудивительно, что сложных веществ существует гораздо больше, чем простых.
Рассмотрим еще раз рисунок и увидим, что молекула воды состоит из двух атомов водорода и одного атома кислорода. Из таких же атомов состоит и вещество водород пероксида, однако она имеет совсем другие свойства, чем вода. Например, водород пероксида имеет температуру кипения выше на 50°С, обладает обеззараживающими свойствами. Ни одна аптечка не обходится без него, ведь раствором этого вещества под названием «перекись водорода» обрабатывают раны, чтобы они быстрее заживали. Такие отличные от воды свойства перекиси водорода обусловленные различиями в строении его молекулы. Ведь молекула этого вещества состоит из двух атомов водорода и двух атомов кислорода.
![]()
Простые вещества
– это вещества, состоящие из атомов одного элемента.
Подразделяются на две большие группы:
• металлы,
• неметаллы.
Металлы
Металлы — называется группа простых тел, обладающих известными характерными свойствами, которые в типических представителях резко отличают металлы от других химических элементов.
В физическом отношении это по большей части тела твердые при обыкновенной температуре, непрозрачные (в толстом слое), обладающие известным блеском, ковкие, тягучие, хорошие проводники тепла и электричества и прочее. В химическом отношении для них является характерной способность образовать с кислородом основные окислы, которые, соединяясь с кислотами, дают соли.
К металлам относятся: железо, медь, цинк, кальций, калий, алюминий, золото, серебро, натрий, олово, бериллий и т.д.
Неметаллы
Неметаллами называется группа простых тел, обладающих известными характерными свойствами, которые резко отличают неметаллы от других химических элементов.
В физическом отношении это различные тела твердые: твердые, жидкие и газообразные.
К неметаллам относятся: водород, кислород, азот, фосфор, сера, углерод, аргон, неон и т.д.
Заключение
Неорганическая химия в настоящее время является одним из самых больших разделов химии, содержит огромное количество теоретических и практических вопросов, позволяющих получать представления о составе веществ, их физических свойствах, химических превращениях, основных отраслях применения. При владении основными терминами, законами, можно составлять уравнения химических реакций, осуществлять по ним разнообразные математические вычисления. Все разделы неорганической химии, связанные с составлением формул, записью уравнений реакций, решением задач на растворы предлагаются ребятам на выпускном экзамене.