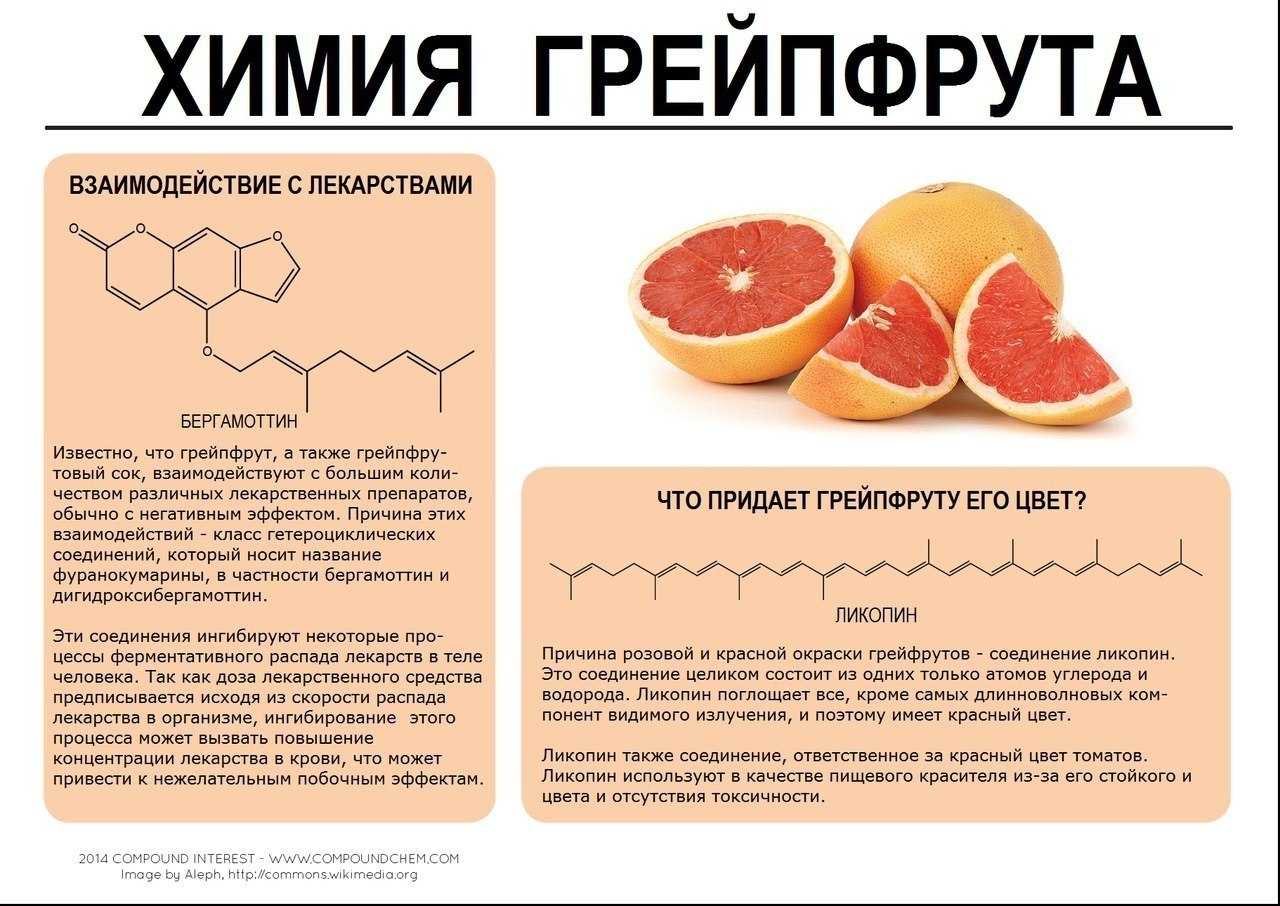
Коагуляция коллоидных растворов
Коагуляция – процесс слипания мелких частиц в крупные агрегаты. Ее можно создать искусственным путем с помощью продолжительного нагревания золя или при взаимодействии смеси с частицами, которые противоположно заряжены. Если частицы практически не вступают в реакцию со средой, то формируется осадок. Если они хорошо взаимодействуют с растворителем, то они вбирают в себя часть жидкости и образуют гелевую структуру.
Решение задач
№1. Чтобы приготовить насыщенный раствор хлорида натрия NaCl надо в 100 мл воды растворить 42 г соли. Какое количество вещества нужно растворить в 400 мл раствора.
Найти массу раствора, учитывая 42 г соли.
m (насыщенного раствора) = m(Н2О) + m(NaCl) = 100 г + 42 г = 142 г
Найти массу соли в 400 мл раствора.
142 г р-ра – 42 г соли
400 г р-ра – х г соли
m (NaCl)= (400 х 42)/142 = 118,3 г
Вычислить молярную массу соли.
M (NaCl) = 23г/моль + 35г/моль = 58 г/моль
Посчитать количество вещество в 118,3 г хлорида натрия.
n (NaCl) = m (NaCl)/М (NaCl) = 118,3 г/58 г/моль = 2,03 моль
Ответ: n (NaCl) = 2,03 моль
№2. Какой объем 0,1 М раствора гидроксида калия КOH можно приготовить из 100 мл раствора гидроксида калия с массовой долей 15% и плотностью 1,138 г/см3?
Найти массу раствора.
m (раствора KOH) = V (KOH) x p (KOH) = 100 мл х 1,138 г/см3 = 113,8 г
Найти массу гидроксида калия в 113,8 г 15%-ного раствора.
100 г р-ра – 15 г в-ва
113,8 г р-ра – х г в-ва
m (KOH) = (113,8 х 15)/100 = 17,07 г
Посчитать молярную массу гидроксида калия.
М (КОН) = 39 г/моль + 16 г/моль + 1 г/моль = 56 г/моль
Найти количество гидроксида калия.
n (КОН) = m (КОН)/М (КОН) = 17,07 г/56 г/моль = 0,305 моль
Найти объем раствора с концентрацией гидроксида калия 0,1 М.
1000 мл – 0,1 моль
V мл – 0,305 моль
V (КОН)= (1000 мл х 0,305 моль)/0,1 моль = 3050 мл
Ответ: V (КОН) = 3050 мл
Смешивание порошков и гранул с высокой сыпучестью и однородным составом
Для смешивания порошков с высокой однородностью гранулометрического состава и большим размером частиц, а также гранулятов с низкой влажностью, адгезией и когезией, используются миксеры барабанного типа и высокоскоростные режимы. Высокая скорость вращения барабана позволяет добиться максимальной гомогенности смеси за короткий период времени.

Внутренне устройство барабана высокоскоростного миксера Pharmag PSM |
Технология перемешивания конкретных компонентов разрабатывается на этапе R&D, исходя их исходных характеристик смешиваемых ингредиентов и результатов анализа свойств получаемой смеси. В зависимости от последних, регулируется скоростной режим и время обработки. В высокоскоростном миксере производства компании Pharma Test можно эффективно перемешивать не только хорошо сыпучие вещества кристаллической формы, но и ингредиенты растительного происхождения с волокнистой структурой частиц. Эффективное перемещение продукта обеспечивается за счет специальных ножей, проталкивающих обрабатываемую массу в верхнюю часть барабана по специальному желобу. |
Если частицы хорошо сыпучих порошков склонны к агломерации, применяются устройства другого типа. Для эффективного перемешивания таких ингредиентов идеально подходит смеситель фармацевтический v-образной формы.

Тестер для определения сыпучести PTG-S4 |
Конструкция приспособления обеспечивает отсутствие так называемых «мертвых зон», благодаря чему в работающем v-образном миксере весь объем продукта находится в постоянном разнонаправленном движении, ни задерживаясь в какой-либо точке пространства. Кроме того, при перемещении порошковой массы в соединенные под углом цилиндрические емкости она распадается на два потока, разбиваясь о металлическое ребро, что предупреждает образование конгломератов. В результате фармацевты получают смесь с требуемой гомогенностью, степень которой определяется с помощью различных анализаторов. |
В модельный ряд сменных насадок Pharmag для универсального привода UAM входит устройство v-образной конструкции. Смеситель отличается возможностью максимально гибкой регулировки скоростного режима, включая работу на предельно малых скоростях при перемешивании деликатных компонентов.
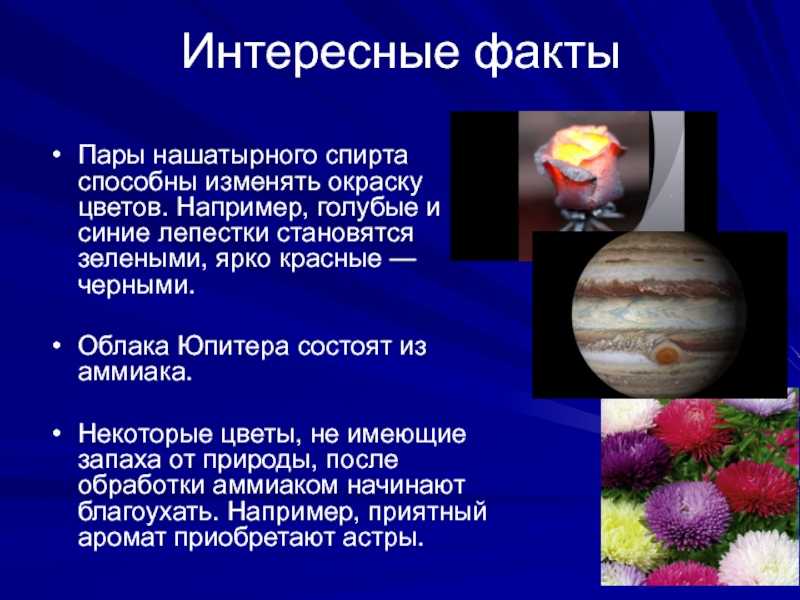
Химия вокруг нас интересные факты. 10 интересных фактов, о химическом элементе Азоте.

Азот — это очень важный элемент, имеющий особое биологическое значение для всех живых существ, а так же, он играет особую роль в современной промышленности. В периодической системе химических элементов Д.И. Менделеева азот находится во II периоде, V группе, главной подгруппе. Но, что же в нем такого особенного? Возможно десять ниже перечисленных фактов об азоте, помогут пролить свет на это вопрос.
1. В конце XVII века, три независимых друг от друга исследователя смогли получить азот во время своих опытов. Имена этих исследователей: Генри Кавендиш, Джозеф Пристли и Даниэль Резерфорд. В 1772 году Генри Кавендиш провёл следующий опыт: он многократно пропускал воздух над раскалённым углём, затем обрабатывал его щёлочью, в результате получался остаток, который Кавендиш назвал удушливым воздухом. С позиций современной химии ясно, что в реакции с раскалённым углём кислород воздуха связывался в углекислый газ, который затем поглощался щёлочью. При этом остаток газа представлял собой по большей части азот. Таким образом, Кавендиш выделил азот, но не сумел понять, что это новое простое вещество (химический элемент). В результате подобного эксперимента азот был получен и Джозефом Пристли и кстати схожие эксперименты в то время проводил так же Карл Шееле. Однако, лишь Даниэль Резерфорд в том же 1772 г. в своей диссертации «Испорченный воздух» подробнее всех описал свойства полученного им вещества: оно не реагирует со щелочами, не поддерживает горение и непригодно для дыхания. Именно поэтому он и стал считаться первооткрывателем азота. Слово «азот» происходит от греческих терминоэлементов а – отрицающий, зоэ – жизнь. Позже, Лавуазье предложил латинское название данного элемента Nitrogenium. Поэтому в периодической системе азот обозначается символом N. Как простое вещество азот образует двухатомные молекулы N2.

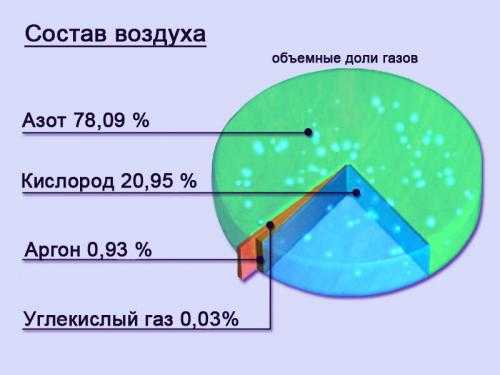
2. По объему азот занимает 4/5 земной атмосферы. Значительные количества азота содержатся в водах мирового океана и в земной коре. 2.5% массы всех живых организмов приходится на азот.
3. Как правило, чистый азот совершенно безвреден для человека. В конце концов, на 78.1% из него состоит воздух, которым мы дышим. В обычном состояние это газ, без цвета, вкуса и запаха. Однако, при высокой концентрации в воздухе, азот может вызывать чувство опьянения, удушья и даже привести к смерти. Так же страшен азот и при кессонной болезни ныряльщиков на глубину.
4. Раньше азот получали из множества различных минеральных веществ. Например, при разложение нитрита аммония:
NH4NO2 = N2 + H2O
При нагревание дихромата калия с сульфатом аммония:
K2Cr2O7 + (NH4)2SO4 = (NH4)2Cr2O7 + K2SO4
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
При пропускание аммиака над оксидом меди (II):
3CuO + 2NH3 = N2 + 3Cu + 3H2O
И т.д.
Однако сейчас примерно миллиард тон азота в год добываются прямо из атмосферы.
5. Мгновенная заморозка чего бы то ни было в жидком азоте, это распространенный кинематографический миф. Жидкий азот действительно имеет очень низкую температуру (-192 градуса Цельсия), но и теплоемкость этого газа низка настолько, что время замораживания даже небольших предметов исчисляется множеством минут.
Активнее всего жидкий азот используется в различных охлаждающих аппаратах, так как инертность азота в отношение других веществ делает его идеальным хладагентом.

6. Азот – очень эффективное средство пожаротушения. Пожары в городе им тушат редко, так как газ сложно оперативно доставить к очагу возгорания и он быстро испаряется на открытой местности. Однако, внутри шахт такой метод тушения пожаров применяется очень часто.
7. Оксид азота (I) (N2O), так же известный как закись азота или веселящий газ, используется для наркоза и улучшает работу двигателей автомобилей. Сам он не горит, но очень хорошо поддерживает горение.
Оксид азота (II) (NO) – очень ядовитое вещество. Однако, в микродозах он содержится во всех живых организмах. В теле человека монооксид азота вырабатывается для нормализации работы сердца, а так же для предотвращения гипертонии и инфарктов.
8. Огромные количества получаемого сегодня азота расходуются на производства садовых удобрений и взрывчатых веществ.
9. А знаете ли вы, что в трубочке ртутного медицинского градусника, помимо серебристого вещества ртути находится так же бесцветный газ азот.

10. Азот, вместе с водородом, кислородом и гелием являются четверкой самых распространенных элементов во Вселенной.
Смеси
Что же такое смесь? Это вещество, компоненты которого перемешаны, но не соединены между собой химической связью.
На первый взгляд такое толкование может показаться довольно странным и непонятным, но давай рассуждать дальше. Если элементы вещества не связаны химически, это означает, что в любой момент их можно разъединить. Это действительно так! Например, если смешать железо с серой, то при помощи магнита можно легко извлечь частички железа, в то время как сера не будет реагировать на магнит.
 Притяжение частичек железа магнитом
Притяжение частичек железа магнитом
Основные отличительные признаки смесей:
- смесь можно разделить на отдельные компоненты;
- все компоненты сохраняют свои индивидуальные свойства;
- компоненты в смесях находятся в разных пропорциях.
«Светящийся монах»

Именно под таким прозвищем стал известен советский ученый-химик Семен Вольфкович, занимавшийся в двадцатые годы двадцатого века разработкой новой технологии получения концентрированных фосфорных удобрений. В те годы свойства фосфора не были достаточно хорошо изучены, а сам он считался вполне безвредным веществом
Поэтому Вольфкович не считал нужным принимать какие-либо серьезные меры предосторожности во время опытов. Именно это и сыграло с ним злую шутку
Со временем его одежда и обувь очень сильно пропитались газообразным фосфором, поэтому когда академик поздно вечером возвращался из МГУ домой, то до смерти пугал прохожих. Люди видели нечто, движущееся по улице и светящееся голубоватым светом. Вдобавок от подошв шли искры. Ученому приходилось каждый раз успокаивать случайных свидетелей и объяснять им это явление. Однако, эта история еще долго переходила из уст в уста под название «светящийся монах». Но благодаря этому было открыто свойство свечения фосфора в темноте.
Соединения
В соединении атомы двух или более элементов связаны вместе химической связью, так что образуется совершенно новое вещество. Углекислый газ — это соединение, состоящее из связанных атомов углерода и кислорода.
атом
Хотя элементов всего около ста, они могут соединяться самыми разными способами, поэтому в мире существует не меньше двух миллионов соединений. Вода — это соединение водорода с кислородом. Стекло — соединение кальция, кремния, кислорода и натрии. Соединения делятся на группы в соответствии с их химическими свойствами. Так, кислоты и основания составляют особые группы. Соединения можно также разделить по признаку наличия тех или иных атомов. Например, гидриды — это вещества, содержащие водород. Хлориды содержат хлор, оксиды содержат кислород. При реакция натрия с хлором, образуется хлорид натрия — поваренная соль. Хлор — ядовитый газ, а натрий — очень активный металл. Хлорид натрия не обладает этими опасными свойствами.
Все органические соединения содержат углерод. Все живые организмы, как и ископаемое топливо, например нефть, состоят из органических соединений. Люди также производят органические соединения — пластмассы, красители, моющие средства, лекарства.
Откуда же берётся энергия?
Энергия накопляется в растениях в процессе фотосинтеза. Значение этого процесса для существования жизни на Земле тяжело переоценить. Именно зелёное растение является той единственной в мире лабораторией, которая усваивает солнечную энергию и сохраняет её в виде химических связей синтезированных им углеводородов. Зелёное растение образует питательные вещества для животного и растительного мира, которые не имеют зелёной окраски. Оно в буквальном понимании слова кормит, одевает и согревает нас. Горят дрова, нафта или газ – всё это результат его жизнедеятельности. Поглощённый сотни миллионов лет назад зелёным растением солнечны й луч сохранился до наших дней в виде каменного угля. В хлоропластах зелёных растений происходит фотосинтез – процесс образования органических веществ (сахаров) из неорганических (воды и углекислого газа). Этот процесс происходит лишь под действием света.
Замечание 2
Процесс фотосинтеза происходит и при искусственном освещении, что позволяет выращивать овощи на протяжении года.
Во время фотосинтеза происходит такая реакция:
Пример 1
Каждый год благодаря фотосинтезу на Земле синтезируется около 150 млрд т углеводородов и выделяется более 200 млрд т кислорода.
Вода, которую растения всасывают корнями, и углекислый газ из воздуха превращаются в хлоропластах в глюкозу, а освобождённый кислород выходит в атмосферу. Кислород необходим для дыхания. В листьях глюкоза превращается в крахмал, крахмал может превращаться в сахар и частично оттекать от листа в другие органы растения.
Часть кислорода под действием космических лучей превращается в озон, который образует озоновый слой. Он поглощает коротковолновые космические ультрафиолетовые лучи, которые пагубно действуют на живые организмы.
С процессом фотосинтеза тесно связан другой естественный процесс – дыхание. Дыхание – характерный признак жизни как растительного, так и животного организма. Смерть организма характеризуется полным прекращением дыхания.
Дыхание представляет собой комплекс тесно взаимосвязанных окислительно – восстановительных процессов, которые происходят с участием ферментов. Дыхание является источником энергии для всех биохимических процессов в организме. В процессе дыхания образуются вещества, необходимые для синтеза составных частей цитоплазмы.
Освобождённая в процессе дыхания химическая энергия поддаётся превращениям, обуславливает ряд физиологических процессов в организме (рост, движение, усвоение питательных веществ). Часть её выделяется в виде тепла, часть накопляется в митохондриях в составе АТФ.
Химическая реакция дыхания противоположна фотосинтезу:
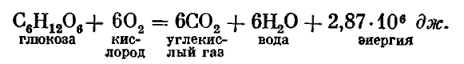
Широко распространено в природе молочнокислое брожение. Оно вызывается целой группой бактерий. Этот процесс используется при квашении капусты, огурцов, помидор, силоса, изготовлении кумыса, кефира, сметаны. Образованная при этом молочная кислота угнетает действие гнилостных бактерий. Закваска для приготовления чёрного хлеба, кроме дрожжей, содержит и бактерии молочнокислого брожения.
Благодаря процессу фотосинтеза зелёные растения накопляют энергию в виде химических связей синтезированных ими органических соединений.
Во время дыхания происходят окислительно – восстановительные реакции, в результате которых накопленная зелёными растениями энергия освобождается. Часть этой энергии используется на процессы жизнедеятельности, часть – на поддержание температуры тела (в случае растений – выделяется в атмосферу), а часть аккумулируется в митохондриях.
Широко распространено и маслянокислое брожение, при котором образуется масляная кислота.
Пример 2
Последствием маслянокислого брожения является прогорклость животного масла при длительном хранении.
Большое значение в природе играют нитрификующие бактерии. Окисляя последовательно аммониак до нитратов, тем самим делают доступным Нитроген для усвоения растениями.
Хемотрофные организмы содействуют процессам кругооборота веществ в природе.
Выпаривание. Кристаллизация
Выпаривание — это способ разделения жидких смесей путём испарения одного из компонентов. Скорость испарения можно регулировать с помощью температуры, давления и площади поверхности испарения.
Пример. Чтобы растворённую в воде поваренную соль выделить из раствора, последний выпаривают:
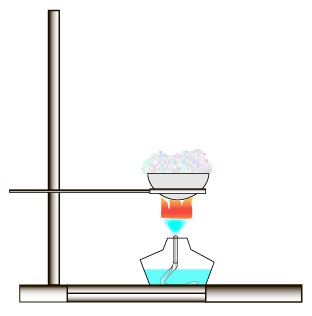
Вода испаряется, а в фарфоровой чашке остаётся поваренная соль. Иногда применяют упаривание, т. е. частичное испарение воды. В результате образуется более концентрированный раствор, при охлаждении которого растворённое вещество выделяется в виде кристаллов. Этот процесс получил название кристаллизации.
Гранит считается наилучшим проводником звука

Звук — это определенные механические колебания, которые происходят в разных средах. Нашим слуховым органом он также может восприниматься. Совсем недавно ученые пришли к такому выводу, что гранит в 10 раз лучше проводит звук, чем сам воздух, которым мы дышим. При этом возрастает не только скорость передачи звука, но и дальность, на которую возможно передать этот звук.
В чем же секрет? На самом деле все просто. Гранит считается одним из самых прочных материалов, которые можно встретить на нашей Земле. Именно поэтому в граните скорость звука может быть намного выше.
Приведем простой пример. Если кто-то делает ремонт в панельном доме, то звук дрели можно будет слышать через весь подъезд.
Ионно-молекулярные уравнения реакций
Из вышеизложенного следует, что в растворах большинства неорганических веществ, наряду с молекулами, находится значительное число ионов. В таком случае уравнения реакций, которые показывают состав молекул реагирующих веществ, весьма условны. Более точно отражают состав реагирующих частиц ионно-молекулярные уравнения.
Для того чтобы составить ионно-молекулярное уравнение реакции, нужно записать в виде ИОНОВ химические формулы:
- сильных и одновременно
- растворимых электролитов.
Состав всех остальных веществ изображается в виде молекул.
На практике, при составлении таких уравнений рекомендуется следовать следующему алгоритму:
1. Определить силу реагирующих электролитов:
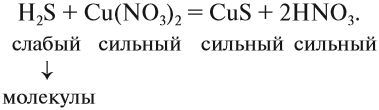
2. Для сильных электролитов определить растворимость (по таблице растворимости):
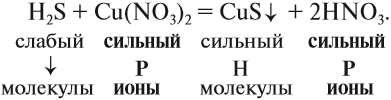
3. Формулы сильных и одновременно растворимых электролитов записать в виде ионов, остальные формулы НЕ ИЗМЕНЯТЬ!
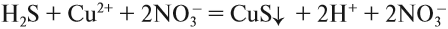
4. Одинаковые ионы «вычеркиваем», так как они не участвуют в реакции (не изменили ни состава, ни заряда), получаем краткое ионно-молекулярное уравнение:
Краткое ионно-молекулярное уравнение показывает:
- что реакция возможна;
- что в результате реакции образуется осадок (СuS);
- какие ионы или молекулы должны участвовать в аналогичном процессе.
Для того, чтобы переписать краткое ионно-молекулярное уравнение в молекулярном виде, необходимо вместо:
- ионов H+ написать формулу сильной кислоты;
- ионов ОH— написать формулу щёлочи;
- остальных ионов написать формулу растворимой соли.
Например, для того чтобы осуществить процесс:
вместо нитрата меди можно взять любую растворимую соль меди (II), так как она при электролитической диссоциации посылает в раствор ион меди, а анион соли в реакции не участвует:
Задание 6.7. Составьте молекулярные и ионно-молекулярные уравнения реакции для этих процессов и убедитесь, что краткие ионно-молекулярные уравнения реакций у них одинаковые.
Задание 6.8. Записать в молекулярном и молекулярно-ионном виде уравнения, соответствующие предложенным кратким молекулярно-ионным уравнениям:
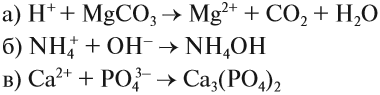
При составлении ионно-молекулярных уравнений может получиться так, что все частицы будут вычеркнуты, так как не изменят ни состава, ни заряда. В этом случае говорят, что реакция в растворе не идёт. В принципе, можно заранее предсказать возможность такого процесса: реакция ионного обмена в растворе возможна, если происходит связывание ионов, т. е. образуется осадок, газ, слабый электролит или ион нового состава.
Задание 6.9. Составьте ионно-молекулярные уравнения реакций:
- фосфат натрия + хлорид кальция →
- карбонат бария + азотная кислота →
- гидроксид железа III + серная кислота →
- сульфат аммония + гидроксид калия →
- нитрат алюминия + хлорид натрия →
Сделайте заключение: возможны ли эти процессы. Укажите признаки возможных процессов (осадок, газ, слабый электролит).
Вывод: любая реакция ионного обмена протекает в сторону связывания ионов, поэтому в результате такой реакции образуется слабый электролит или осадок, или газ.
Презентация на тему: » Дисперсные системы. Смеси веществ истинные растворы дисперсные системы.» — Транскрипт:
1
Дисперсные системы
2
Смеси веществ истинные растворы дисперсные системы
3
Растворы- это гомогенные (однофазные) системы, состоящие из двух и более компонентов (составных частей) и продуктов их взаимодействия.
4
Растворы твердые дуралюмин газообразные воздух жидкие раствор поваренной соли в воде
5
Дисперсные системы – гетерогенные (неоднородные) системы, в которых одно вещество в виде очень мелких частиц равномерно распределено в объёме другого.
6
Дисперсные системы состоят как минимум из двух компонентов: 1. которая играет роль растворителя и, следовательно, является непрерывной фазой; 1. дисперсионной среды, которая играет роль растворителя и, следовательно, является непрерывной фазой; 2. дисперсной фазы, играющей роль растворённого вещества.
7
-. — Дисперсная фаза — вещество, которое присутствует в дисперсной системе в меньшем количестве. Дисперсионная среда — вещество, которое в дисперсной системе находится в большем количестве. Дисперсионная среда Дисперсная фаза
8
Классификация дисперсных систем: 1. По величине частиц веществ, составляющих дисперсную фазу А) грубодисперсные (взвеси) с размерами частиц более 100 нм Б) тонкодисперсные (коллоидные растворы или коллоидные системы) с размерами частиц от 100 до 1 нм.
9
ВЗВЕСИ Взвеси – это дисперсные системы, в которых размер частицы фазы более 100 нм. Это непрозрачные системы, отдельные частицы которых можно заметить невооруженным глазом. Дисперсная фаза и дисперсная среда легко разделяются отстаиванием, фильтрованием.
10
Эмульсия – это дисперсная система с жидкой дисперсионной средой и жидкой дисперсной фазой (прямая, обратная). Суспензия – это дисперсная система с жидкой дисперсионной средой и твердой дисперсной фазой (паста, взвесь). Аэрозоли – это дисперсная система, в которой дисперсионной средой является газ, а дисперсной фазой – жидкость. ВИДЫ ВЗВЕСЕЙ
11
КОЛЛОИДНЫЕ СИСТЕМЫ Коллоидные системы (в переводе с греческого колла – клей, еидос вид клее подобные) – это такие дисперсные системы, в которых размер частиц фазы от 100 до 1 нм. Эти частицы не видны невооруженным глазом, и дисперсная фаза и дисперсная среда в таких системах отстаиванием разделяются с трудом.
12
Гель – это студенистый, не текучий раствор. Золь – это подвижный текучий коллоидный раствор. К золям относят кровь, лимфу, цитоплазму.
13
Эффект Тиндаля — рассеяние света при прохождении светового пучка через оптически неоднородную среду. Обычно наблюдается в виде светящегося конуса (конус Тиндаля), видимого на тёмном фоне. Назван по имени открывшего его Дж. Тиндаля.. Слева – раствор крахмала, справа — вода
14
Коагуляция Коагуляция – явление слипания коллоидных частиц и выпадения их в осадок. При этом раствор превращается в суспензию или гель. Некоторые органические коллоиды коагулируют при нагревании (клей, яичный белок) или при изменении кислотно-щелочной среды раствора.
15
Синерезис Со временем структура гелей нарушается (отслаивается) – из них выделяется вода. Это явление называют синерезисом.
16
Классификация дисперсных систем 2. По агрегатному состоянию.
17
Роль дисперсных систем Для химии наибольшее значение имеют дисперсные системы, в которых средой является вода и жидкие растворы. Природная вода всегда содержит растворённые вещества. Природные водные растворы участвуют в процессах почвообразования и снабжают растения питательными веществами. Сложные процессы жизнедеятельности, происходящие в организмах человека и животных, также протекают в растворах. Многие технологические процессы в химической и других отраслях промышленности, например получение кислот, металлов, бумаги, соды, удобрений протекают в растворах.
Круговорот веществ
Горение, дыхание, фотосинтез имеют химическую природу и являются важными звеньями планетарных процессов – кругооборотов Оксигена и Карбона.
Упрощённо кругооборот Оксигена в природе можно описать как процесс образования кислорода в результате фотосинтеза растений и использование его во время дыхания, в реакциях окисления и горения. Кругооборот Оксигена связывает атмосферу и гидросферу с земной корой.
Карбон – составная всех органических веществ, его кругооборот связан с кругооборотом Оксигена. Горение ископаемого топлива, образование глюкозы и крахмала из углекислого газа и воды во время фотосинтеза, обменные процессы в живых организмах, гниение отмерших органических остатков – звенья кругооборота Карбона.
Дыхание – череда процессов, в ходе которых органические вещества сложного строения окисляются с образованием углекислого газа и воды.
Окисление и восстановление – две стороны единого окислительно – восстановительного процесса. В масштабах планеты Земля окисление вследствие горения и дыхания «уравновешивается» восстановлением во время фотосинтеза.
Этапы развития химии
Химия – наука о составе, строении и свойствах веществ. Химия изучает процесс превращения этих веществ, а также законы, по которым происходят эти превращения.
Химической деятельностью человек начал заниматься задолго до нашей эры. Это произошло в то время, когда люди научились получать металлы. Потом началось производство керамики, стекла, дубление кож, крашение тканей, создание лекарственных средств, изготовление косметики.
Ещё в 300 г. до нашей эры египтянин Зосима создал энциклопедию, которая состояла из 28 томов. В этих томах были собраны знания по взаимным превращениям веществ за последние 500-600 лет.
Алхимия
Начальным этапом развития химии можно считать появление алхимии. В основе алхимии лежали представления древнегреческих философов Эмпедокла, Платона и Аристотеля об элементах природы и их взаимном превращении.
Считалось, что существуют четыре первоначала: земля, вода, воздух и огонь. И они способны переходить друг в друга, так как каждое из них является одним из состояний единой первоматерии.
А все вещества образуются в результате сочетания этих первоначал.
Алхимики превращали одни вещества в другие. Они полагали, что подобным превращениям могут подвергаться и металлы. Многие учёные были заняты поисками «философского камня», который должен был превращать неблагородные металлы в золото.
И во время этих поисков в своих лабораториях алхимики научились получать щёлочи, многие соли, серную и азотную кислоты, этанол. С помощью этих веществ они могли воздействовать на другие вещества.
В середине XIII века европейские алхимики получили порох.
Следует сказать, что алхимия в Европе была под запретом. Заниматься алхимией запрещали как церковь, так и светские власти. Но, несмотря на это, алхимия была популярна вплоть до начала XVI века.
Развитие химии как науки
В XVI веке ирландский учёный Бойль освободил химию от алхимии. Он предположил, что все вещества состоят из химических элементов, которые нельзя разложить на более простые части. Можно сказать, что с этого времени химия стала отдельной наукой.
В конце XVII – начале XVIII веков появляется теория немецкого химика Э.Г. Шталя, объясняющая явления горения, окисления и восстановления металлов. Но эта теория была признана ошибочной в середине XVIII века французским физиком Лавуазье, установившим роль кислорода в этих процессах. М.В. Ломоносов открыл закон сохранения массы вещества в химических процессах.
C конца XVIII до середины XIX века был открыт целый ряд стехиометрических законов, устанавливающих количественные соотношения (массовые и объёмные) между реагирующими веществами и продуктами реакции. Закон Авогадро, законы сохранения массы, эквивалентов, постоянства состава, объёмных отношений, кратных отношений – это законы, лежащие в основе стехиометрии.
Менделеевым был открыт периодический закон.
После того как в конце XIX века были открыты электрон и радиоактивность, в начале ХХ века была разработана теория гетерополярной (ионной) связи и теория гомеополярной (ковалентной) связи. В 1927 г. началась разработка квантово-механической теории химической связи.
Учение Менделеева о периодичности химических элементов получило своё подтверждение. Стало возможным прогнозировать свойства веществ. Физико-математические методы стали широко использоваться для разнообразных расчётов в области химии.
Появились новые физико-химические методы анализа: электронная и колебательная спектрометрия, магнетохимия и т.д.
https://youtube.com/watch?v=1cYXor5zGmc
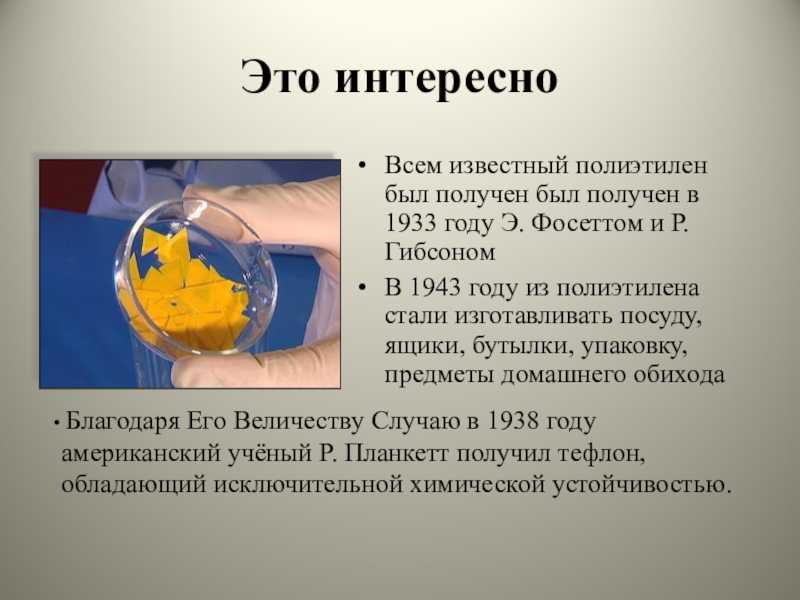
В ХХ веке благодаря достижениям химической науки стало возможным получение веществ с заданными свойствами: синтетических антибиотиков, синтетических полимеров, пластмасс, всевозможных строительных материалов, тканей и т.п.
Современная химия тесно сотрудничает с другими науками. В результате появились совершенно новые разделы химии: биохимия, геохимия, коллоидная химия, кристаллохимия, электрохимия, химия высокомолекулярных соединений и др.
Важным направлением современной химии является получение дешёвого топлива, создающего альтернативу основным современным источникам энергии – нефти и газу.
Точные современные приборы и компьютеры значительно упростили исследования и математические расчёты в области химии, повысили их точность, скорость и уменьшили стоимость.
Химия в повседневной жизни
Без химии невозможно представить современный быт людей. И не только опосредованно, через использование пищи, одежды, обуви, топлива, жилья, но и непосредственно, через использование стеклянных, пластмассовых, фарфоровых и фаянсовых изделий, лекарственных препаратов, средств для дезинфекции, косметических изделий, различных клеев, лаков, красок, пищевых добавок и т. п.
Окончательно вошли в наш быт различные моющие средства. Но кроме мыла и шампуней мы используем много других средств, в частности отбеливателей. Действие большинства из них основано на свойствах хлорсодержащих соединений, являющихся сильными окислителями. На некоторых средствах указывают «Не содержат Хлора». Такие средства содержат другие сильные окислители, например натрий перборат
Создание новых материалов
Создание новых материалов — необходимость современной жизни. Материалы с новыми, улучшенными свойствами должны заменить устаревшие. Новых материалов требуют и высокотехнологичные отрасли: космическая и атомная техника, электроника. Для практических потребностей необходимы металлы, полимеры, керамика, красители, волокна и многое другое.
Особое место среди новых материалов занимают композиты. По многим свойствам — прочности, вязкости — композиты значительно превышают традиционные материалы, благодаря чему потребности общества в них постоянно растут. На создание композитов тратится все больше ресурсов, а главными потребителями композитов сегодня являются автомобильная и космическая отрасли (рис. 40.1).
Биоматериалы
С развитием медицины возникла потребность в замене органов и тканей в организме человека. Материалы, которые можно использовать для изготовления различных имплантов, создают в химических лабораториях. Металлические протезы просты в изготовлении, очень прочны, химически инертны и относительно дешевы. Главным недостатком металлов является то, что они подвергаются коррозии, из-за которой снижается механическая прочность, а организм отравляют ионы металлических элементов. Достаточно перспективными для изготовления имплантов являются сплавы титана (например, Ti–Al–V). Они прочные, относительно легкие и устойчивые к коррозии.
Сегодня все больше используют керамические биоимпланты. Керамика — замечательный биоматериал: она прочная, не поддается коррозии
Кроме того, керамика не стирается, что важно для искусственных суставов, а также характеризуется биосовместимостью
Рациональное использование природного сырья
Природа кажется неисчерпаемой кладовой, из которой человечество берет необходимое сырье. За последние 20 лет полезных ископаемых было потреблено больше, чем за всю историю человечества. В мире ежегодно добывают и перерабатывают около 100 млрд тонн горных пород. Многие сырьевые источники уже истощены, поэтому остро стоит сырьевая проблема. Уже сегодня многие страны испытывают недостаток в отдельных природных ресурсах. В Украине, например, не хватает нефти и природного газа.
Комплексное использование сырья и отходов — основа комбинированных производств (разных химических, химических с металлургическими и др.). Необходимо внедрять безотходные технологии, т. е. такие производственные процессы, при которых отходы одного производства становятся сырьем (реагентами) для другого.
Неисчерпаемым источником сырья являются промышленные и бытовые отходы. Задача химиков состоит в разработке методов эффективного использования таких отходов. Применение вторичного сырья дает возможность экономить природные сырье и энергию, а также снизить себестоимость продукта, поскольку расходы ресурсов в 2–3 раза (а по некоторым видам до 6 раз) меньше, чем производство из первичного сырья. Например, выплавка стали из металлолома требует в 6–7 раз меньше энергетических затрат и в 25 раз дешевле, чем получение стали из руды.
Химия вошла во все сферы жизни и деятельности человечества. В повседневной жизни мы используем много продуктов химической промышленности. Химия позволяет создавать новые материалы, не существующие в природе.