Вариант 2
A1. Из предложенных утверждений выберите верное
1) молекулу можно увидеть невооруженным глазом
2) молекулы различных веществ одинаковы
3) молекулу нельзя разделить на части
4) молекула — это мельчайшая частица вещества
А2. Диффузия происходит благодаря тому, что
1) молекулы неподвижны
2) молекулы непрерывно беспорядочно двигаются
3) все молекулы двигаются в одном направлении
4) молекулы не сталкиваются между собой
А3. Явление диффузии может наблюдаться
1) только в твердых телах
2) только в жидкостях
3) только в газах
4) в газах, жидкостях и твердых телах
А4. При повышении температуры вещества процесс диффузии молекул этого вещества происходит
1) с той же скоростью
2) быстрее
3) медленнее
4) иногда медленнее, иногда быстрее
А5. Между молекулами вещества
1) не действуют никакие силы
2) не действуют силы притяжения
3) действуют силы притяжения на расстояниях, сравнимых с размерами самих молекул
4) действуют силы притяжения на расстояниях, гораздо больших размеров самих молекул
А6. Если вещество сохраняет объем, то оно находится
1) в газообразном состоянии
2) в жидком состоянии
3) в твердом состоянии
4) в жидком или твердом состоянии
А7. Расстояние между молекулами вещества сравнимо с размерами самих молекул. Вещество находится
1) в жидком или твердом состоянии
2) в газообразном состоянии
3) в жидком состоянии
4) в твердом состоянии
А8. Броуновское движение подтверждает существование
1) постоянного беспорядочного движения молекул
2) агрегатных состояний вещества
3) промежутков между молекулами
4) сил притяжения между молекулами
Ответы на тест по физике Строение вещества для 7 классаВариант 1
А1-1
А2-4
А3-2
А4-1
А5-4
А6-3
А7-1
А8-2Вариант 2
А1-4
А2-2
А3-4
А4-2
А5-3
А6-4
А7-1
А8-1
Закон объемных соотношений Гей-Люссака
В химических реакциях с участием газов очень часто наблюдается изменение объема реакционной системы. В отличие от постоянства массы веществ, участвующих в реакции и образуются вследствие нее, при взаимодействии газов объем реакционной системы может увеличиваться, уменьшаться или оставаться неизменным. Соотношение между объемами газов устанавливает закон объемных соотношений Гей-Люссака (1808 г.):
Этот закон справедлив только в том случае, когда объемы газов измерены при одинаковых условиях.
Из закона Гей-Люссака следует, что стехиометрические коэффициенты в уравнении реакции являются кратными к объемам газов, которые взаимодействуют и образуются.
С помощью закона объемных соотношений можно рассчитать объемы газов или устанавливать состав исходного газа.
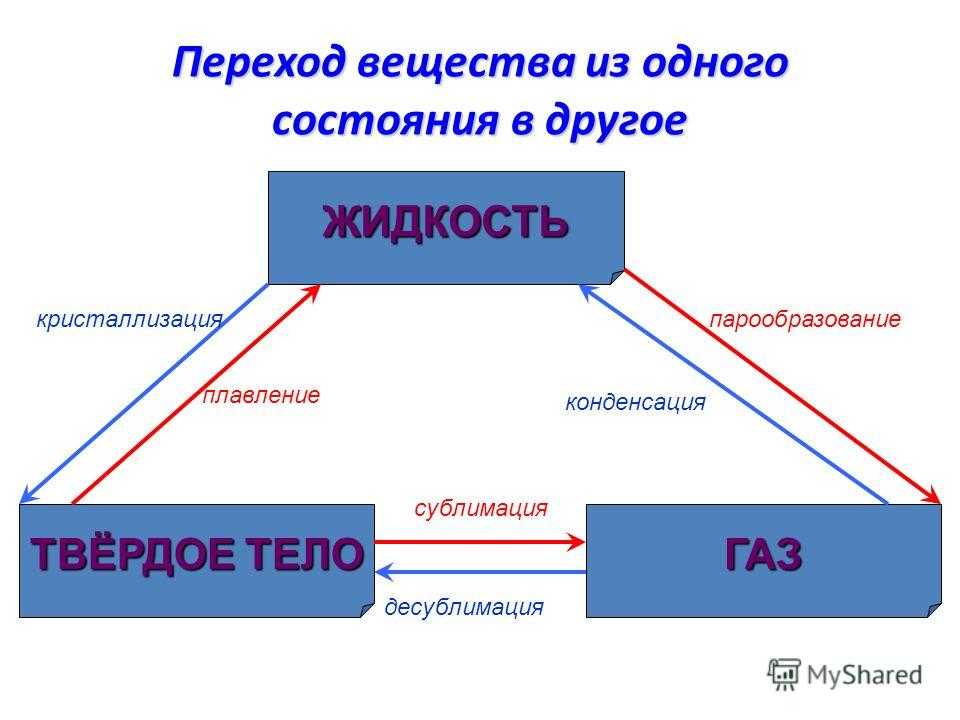
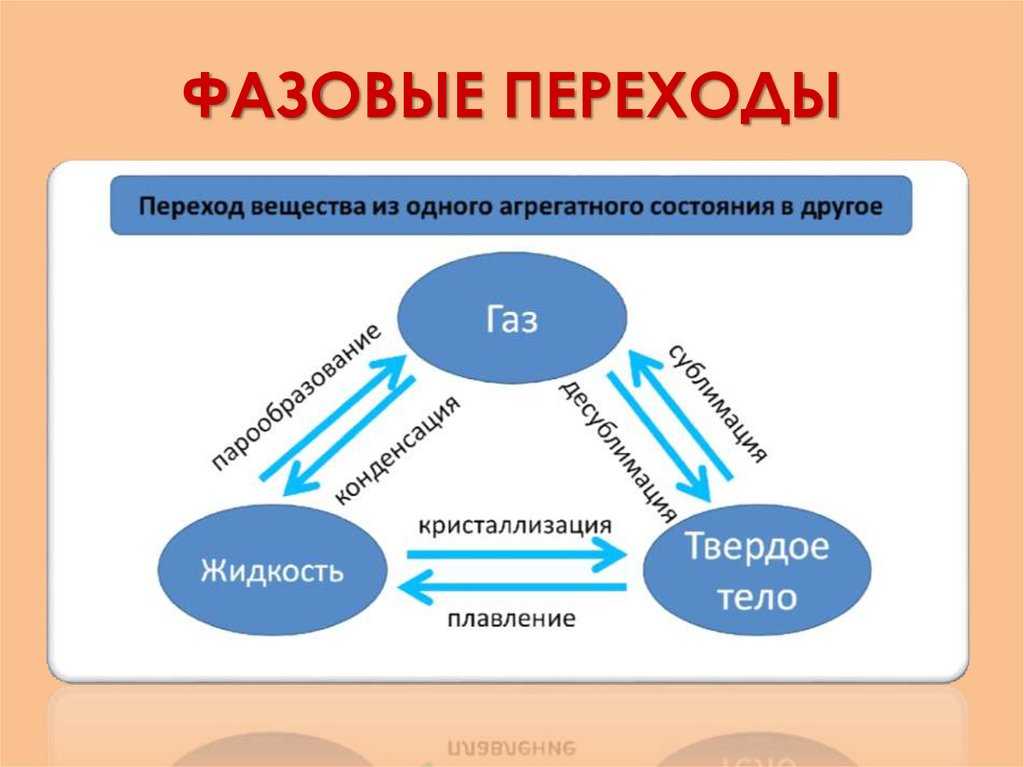
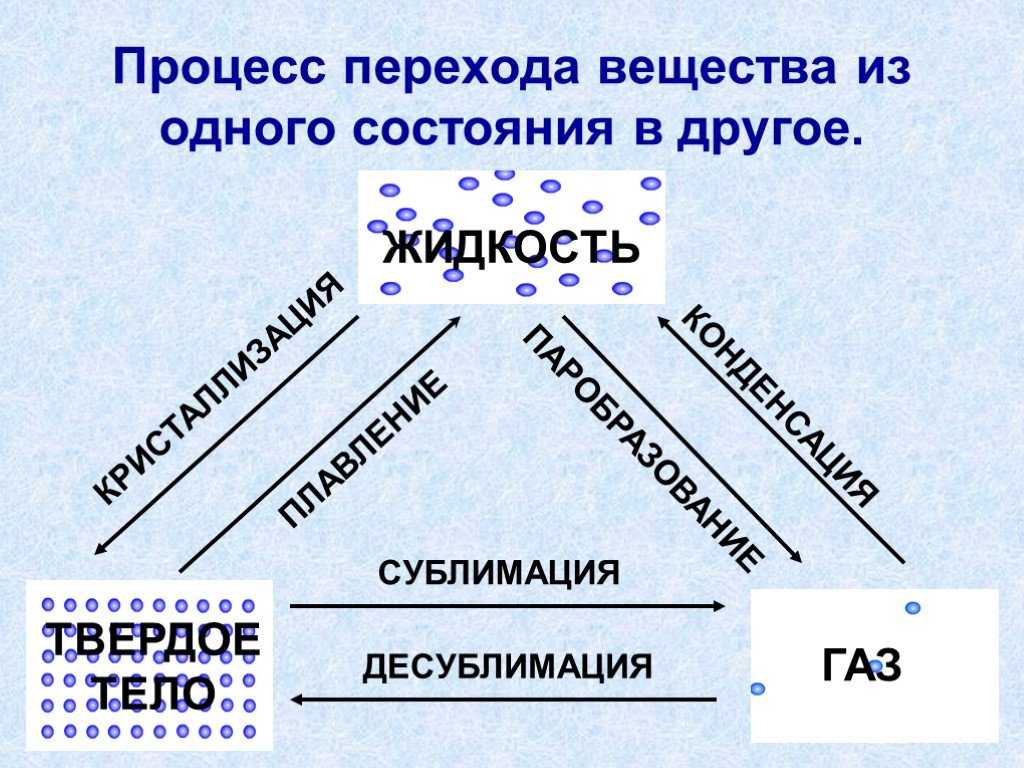
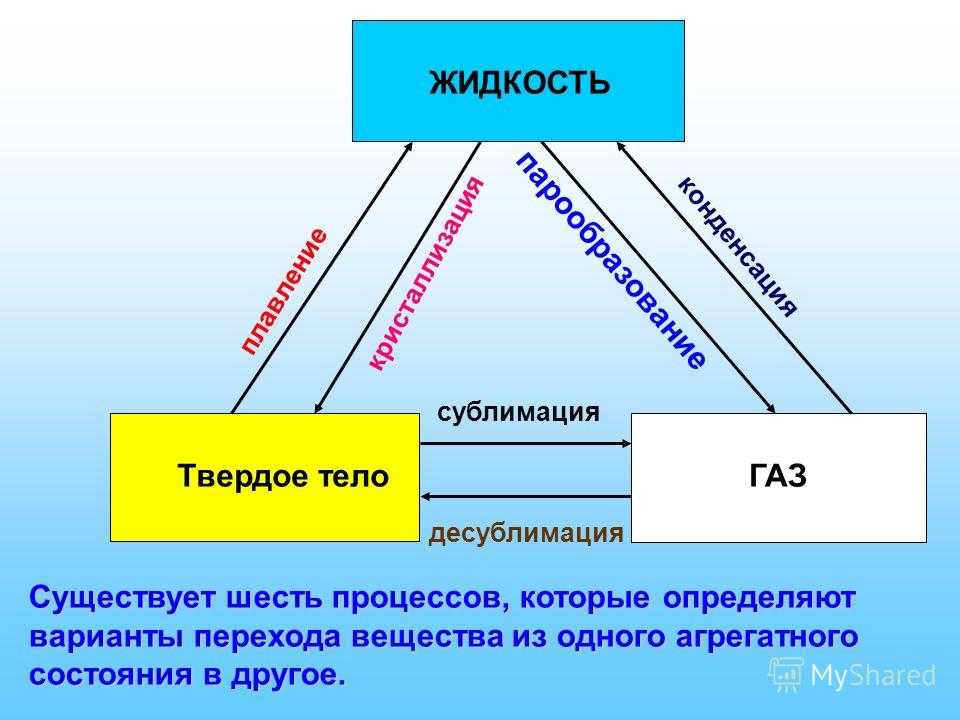
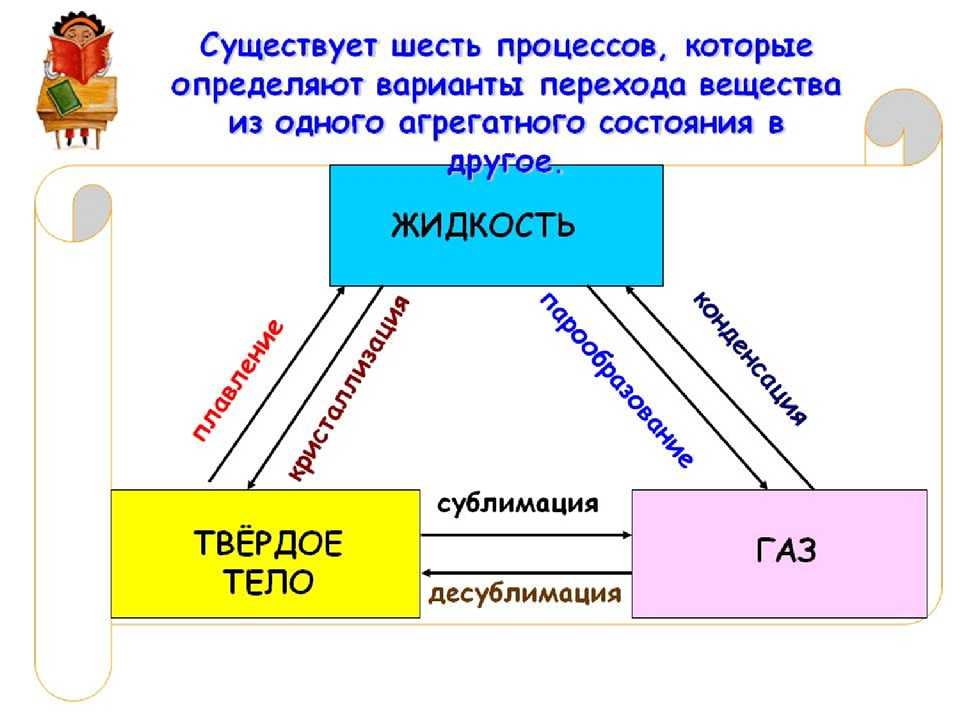
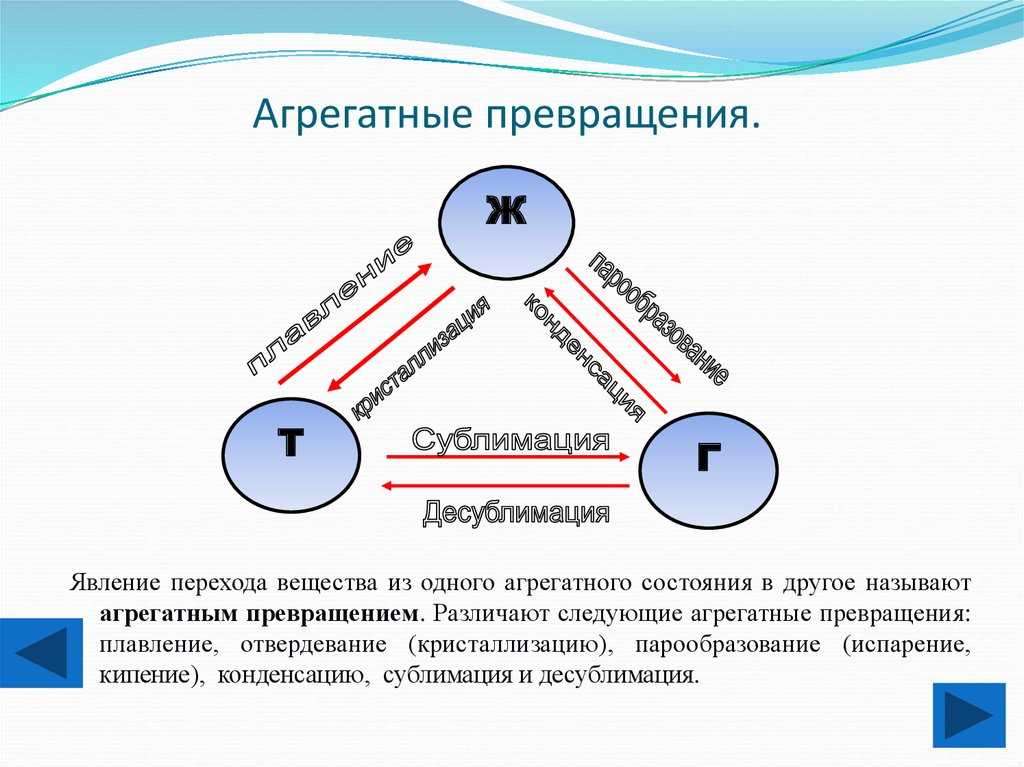
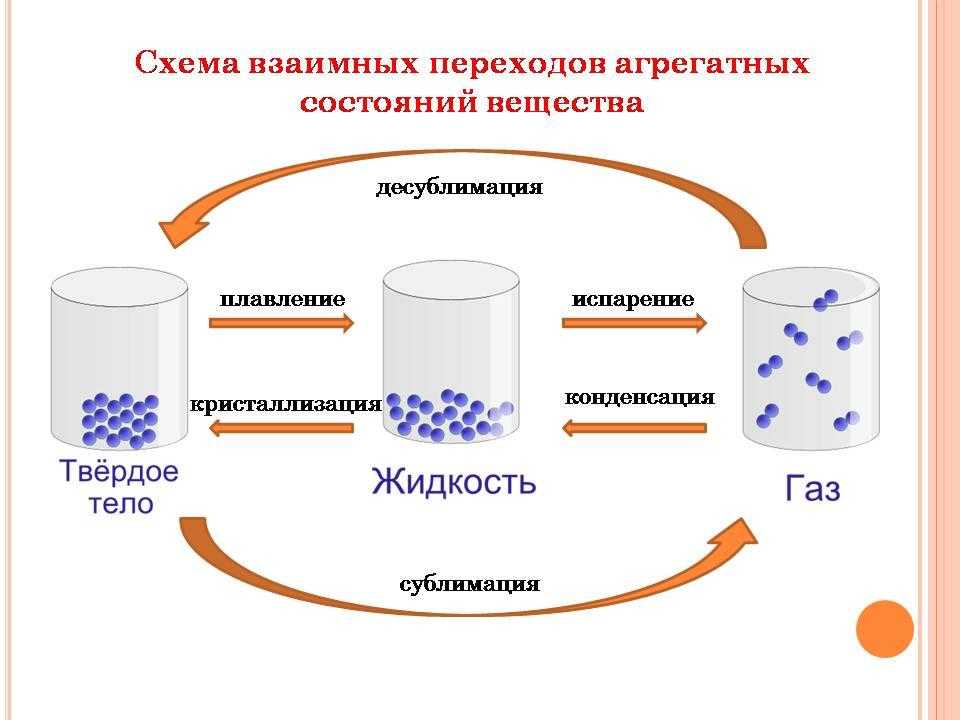
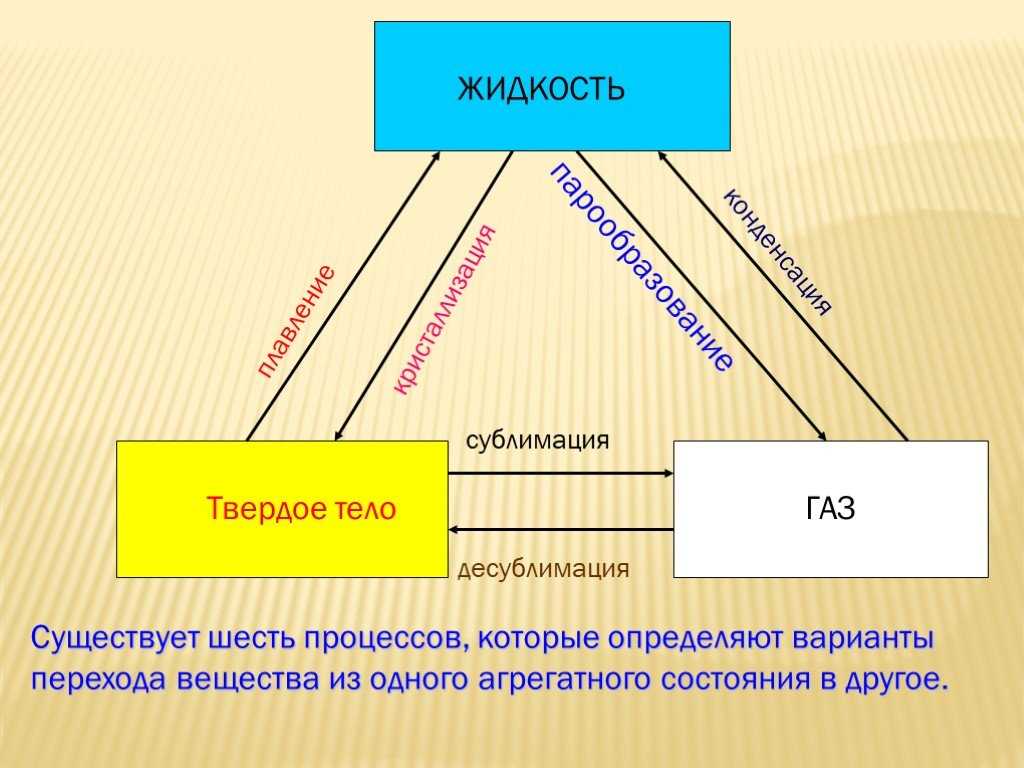
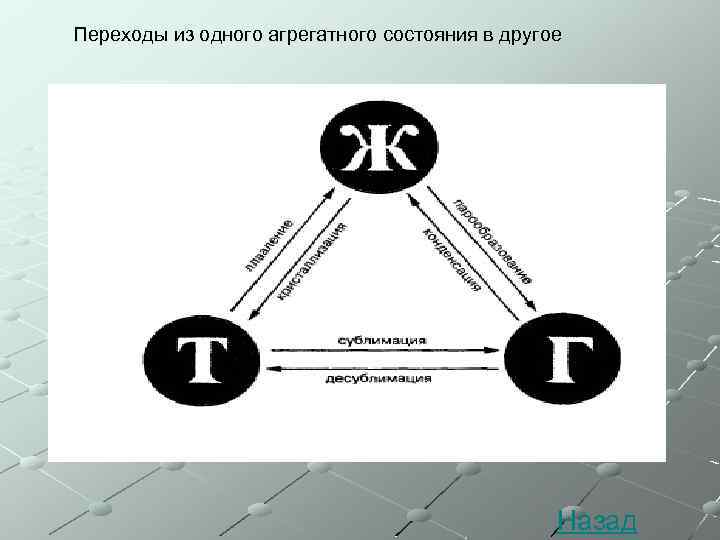
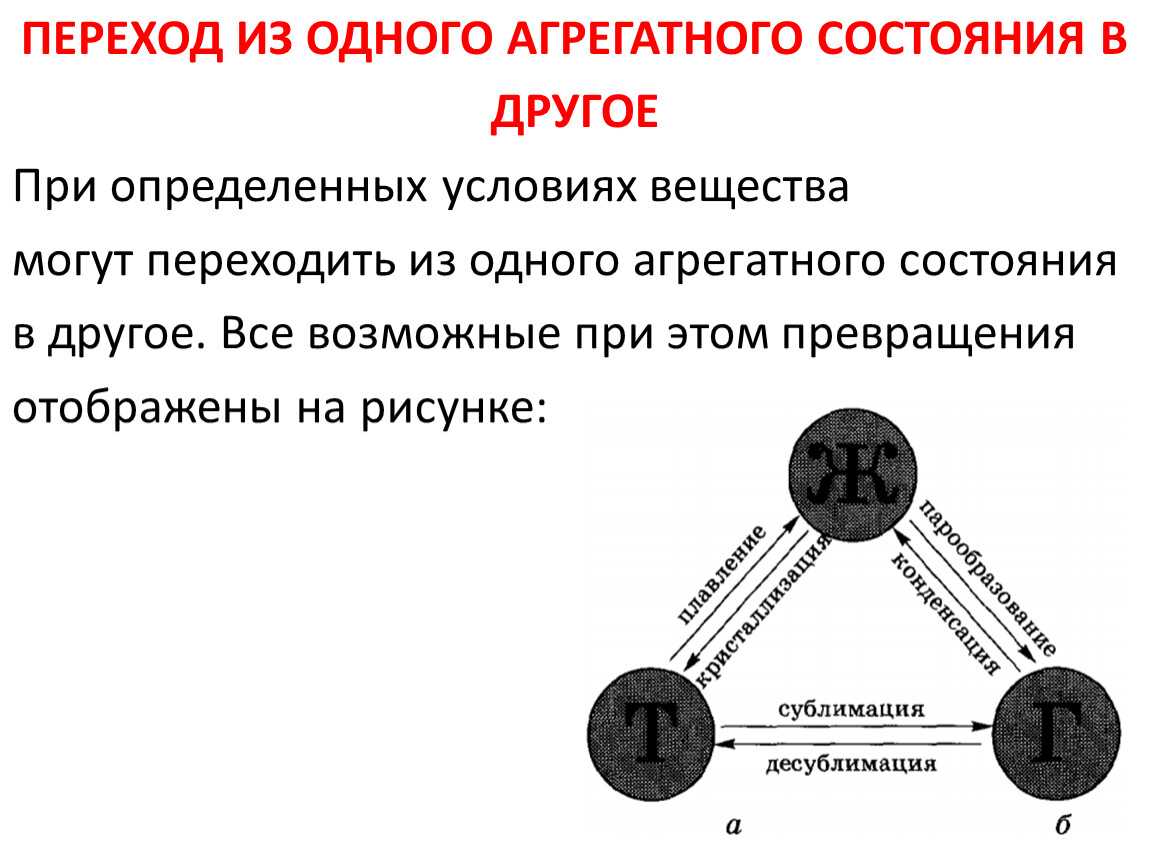
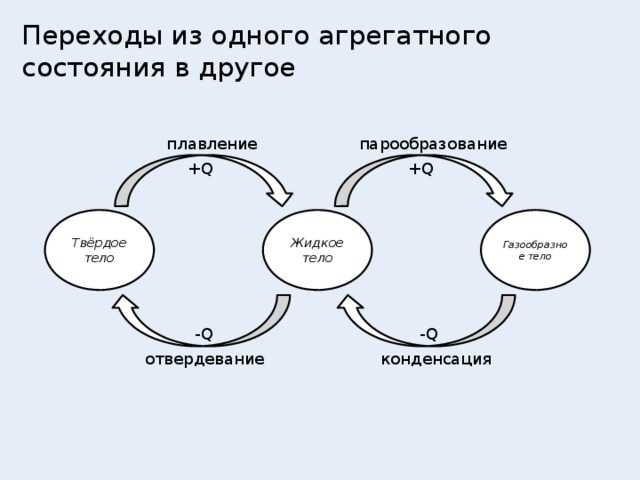
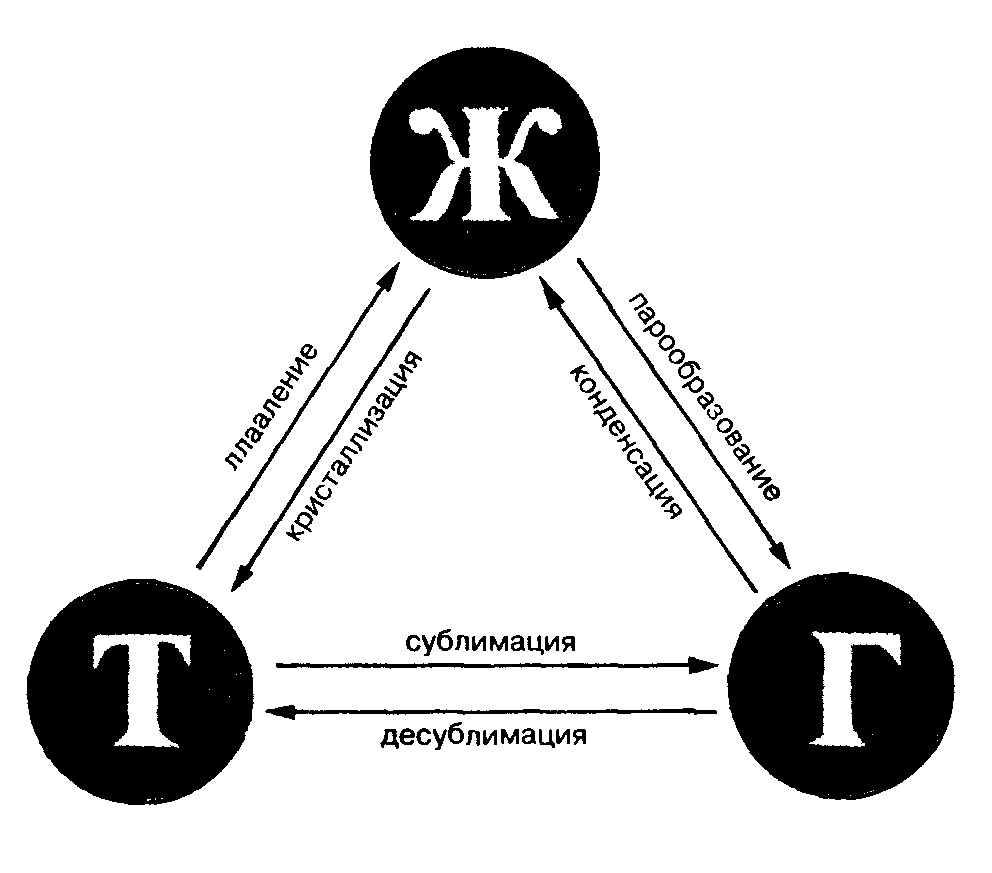
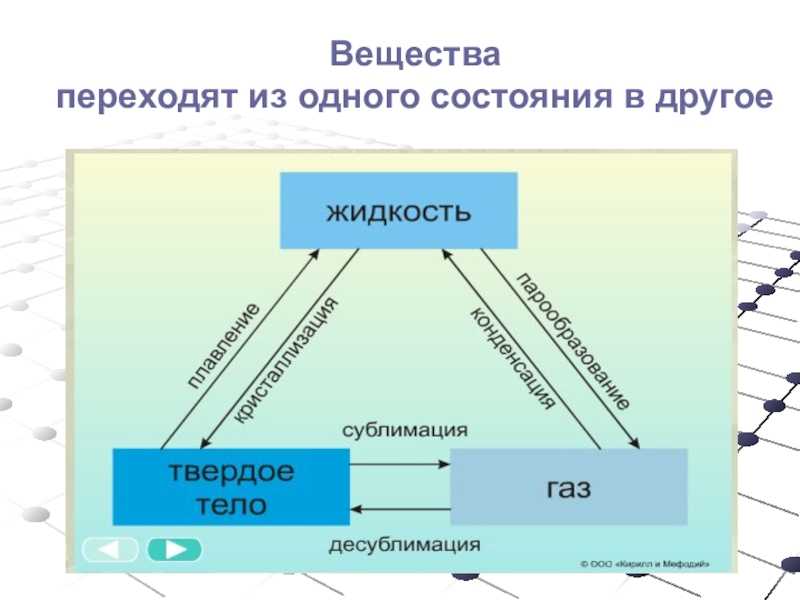
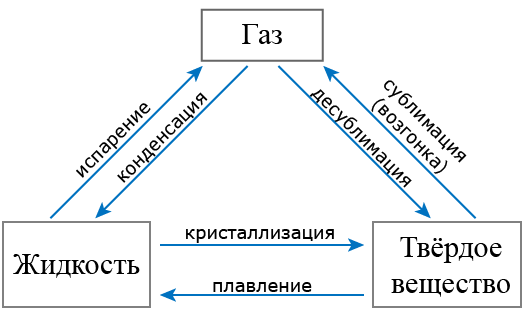
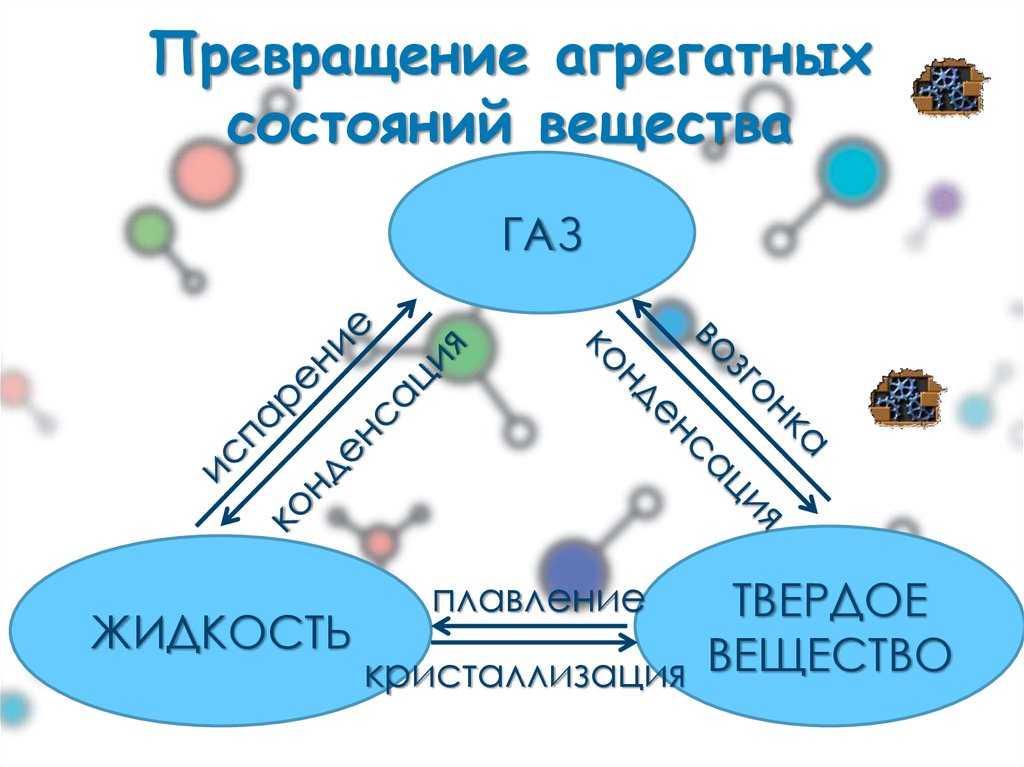
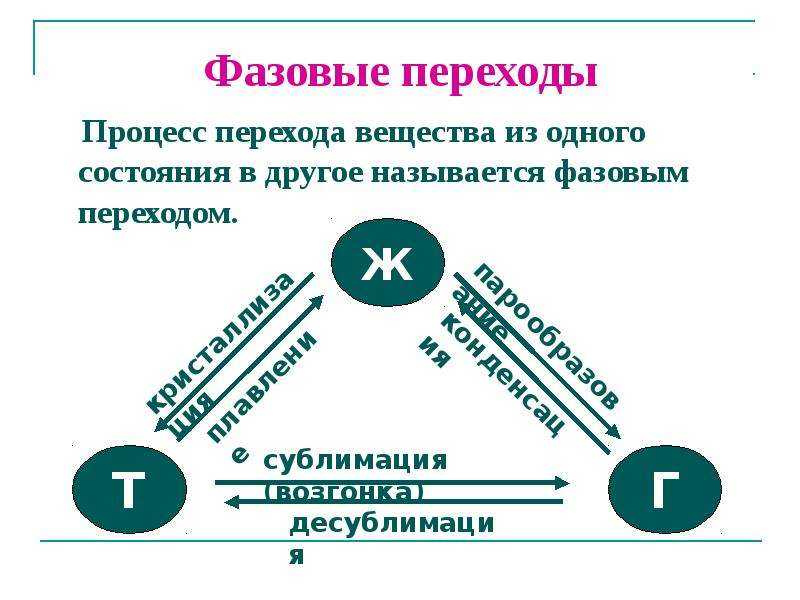
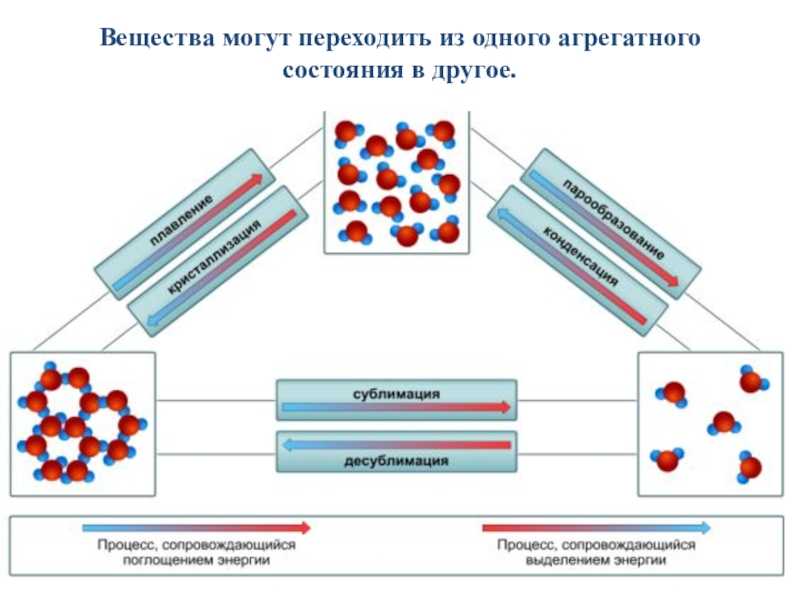
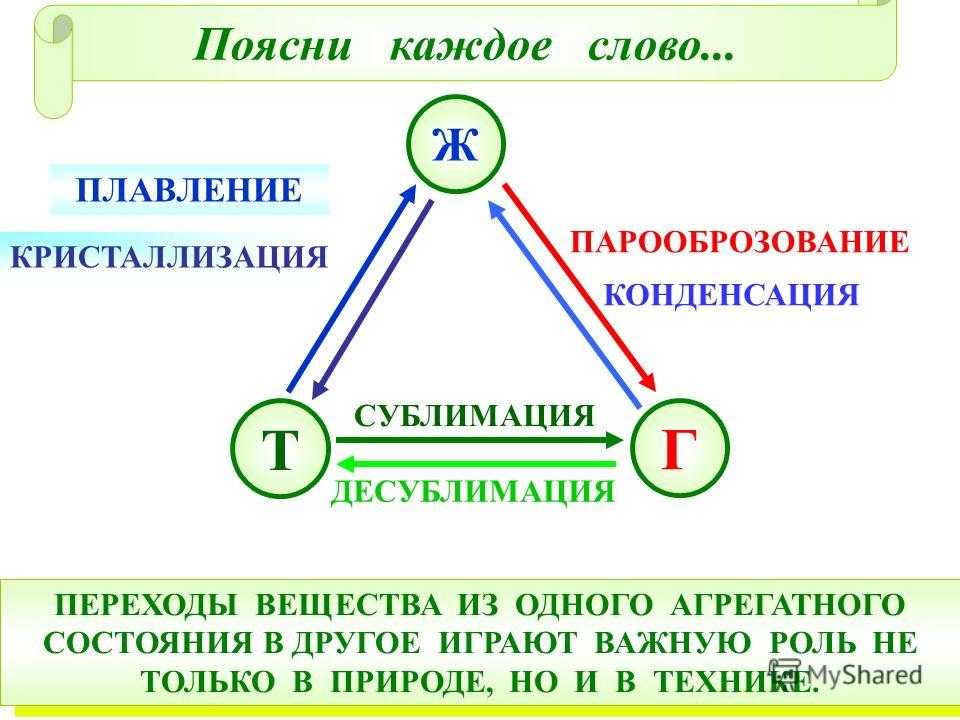
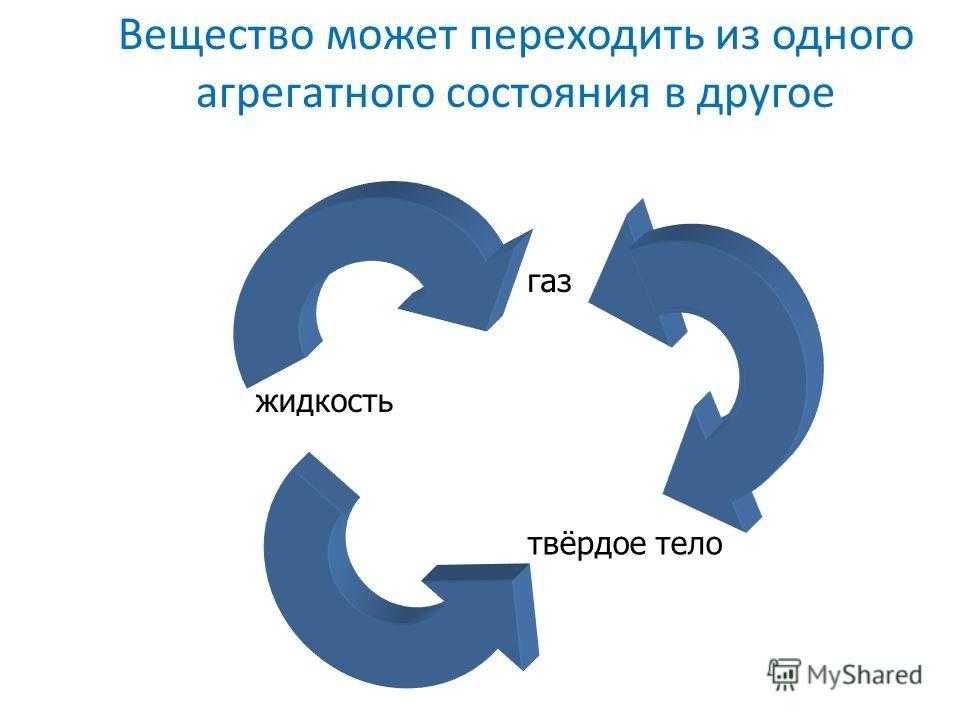
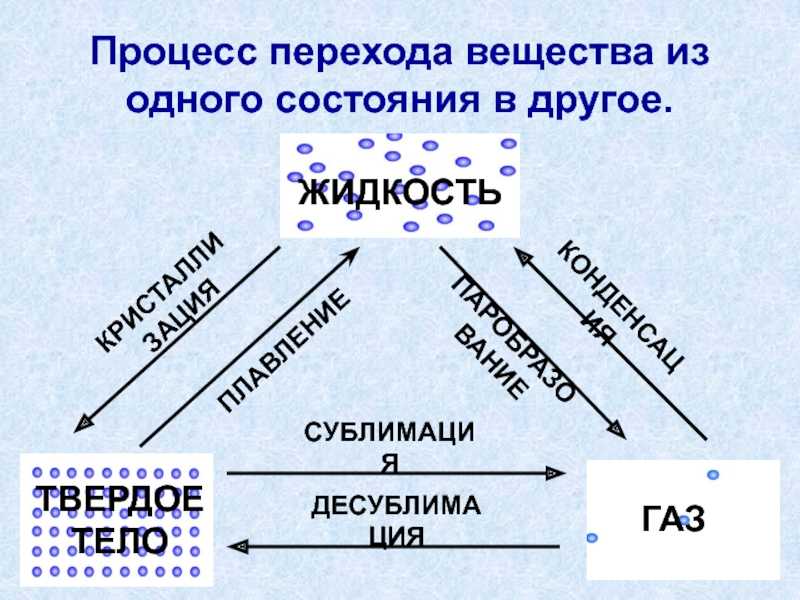
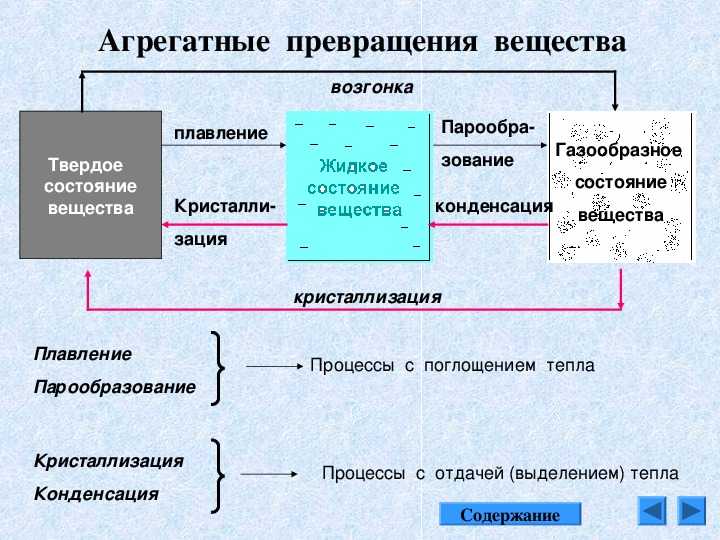
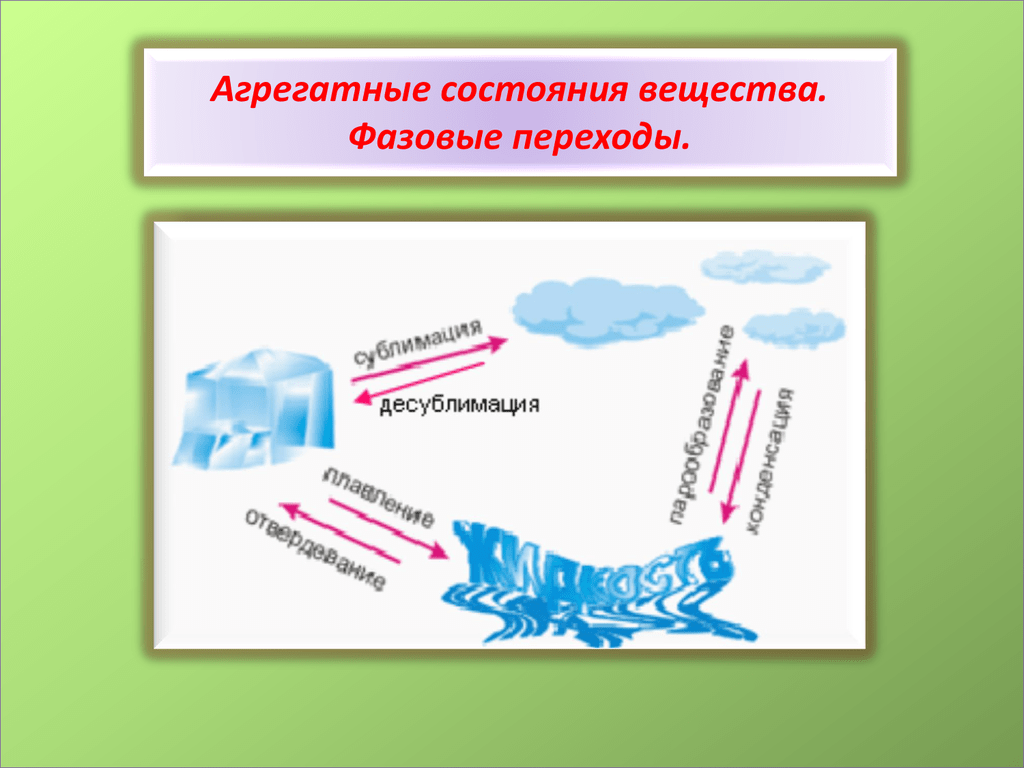
Фазовые переходы: изменение агрегатных состояний вещества
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Фазовые переходы интересны тем, что все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы металлургии и микроэлектроники.
На схеме — названия всех фазовых переходов:
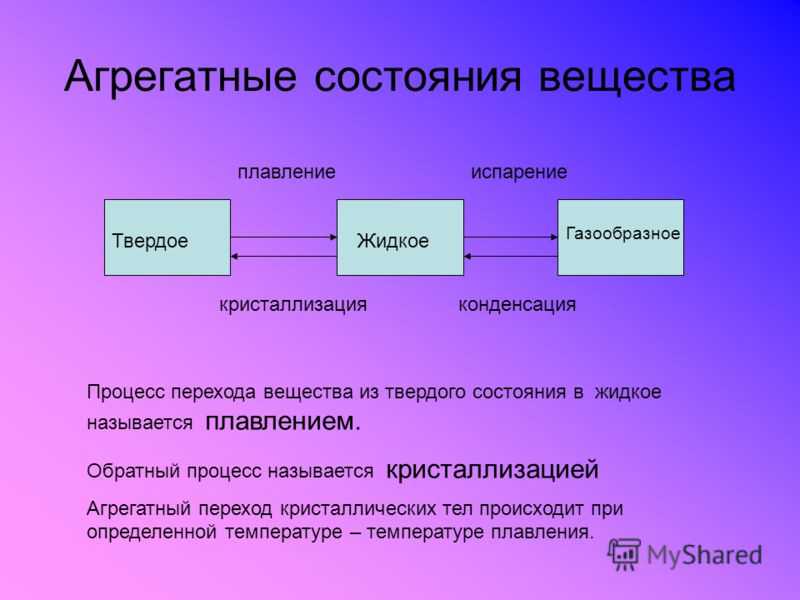
Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
График фазовых переходов
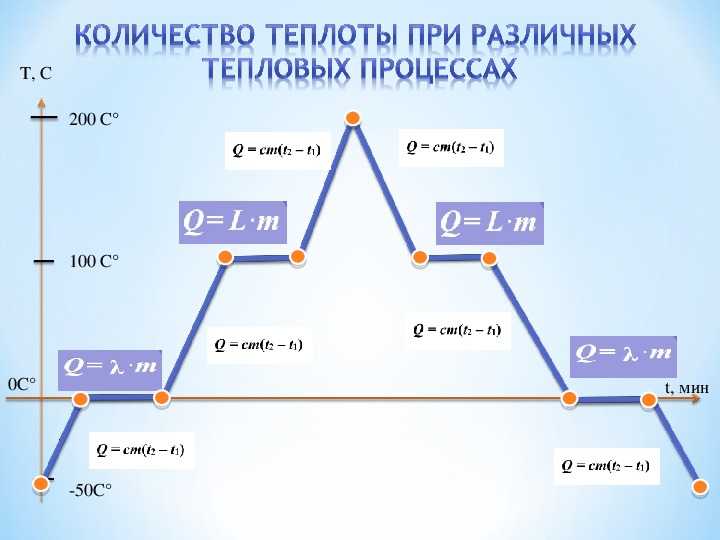
Если взять процесс превращения льда в воду, воды — в пар, и обратные действия, то мы получим очень информативный график.
Разбираемся по шагам.
AB — нагревание льда
Сначала взяли лед, конечно, при отрицательной температуре,
потому что при нуле лед начинает плавиться. Нагрели лед до температуры плавления (до 0 градусов Цельсия).
BC — плавление льда
После того, как лед нагрелся до температуры плавления, он начинает плавиться. В точке B это еще лед, а в точке C — уже вода. Плавление происходит при постоянной температуре и тем дольше длится, чем больше масса плавящегося вещества. Еще этот процесс зависит от свойств самого вещества, но об этом немного позже.
CD — нагревание воды
Расплавленное вещество уже в жидком состоянии снова начинает нагреваться, и температура увеличивается, пока не достигает температуры кипения. В данном случае нагревается вода — это значит, что ее температура кипения равна 100 градусам Цельсия.
DE — кипение (парообразование) воды
При 100 градусах вода кипит, пока не выкипит целиком. В данном случае процесс, как и плавление, происходит при постоянной температуре. Но парообразование нельзя путать с испарением, потому что парообразование происходит при конкретной температуре, а испарение — при любой.
EF — нагревание пара
Далее полученный пар нагревается, но путем нагревания невозможно дойти до другого фазового перехода — можно пойти только обратно.
FG — охлаждение пара
Первый шаг в обратную сторону — охлаждение до температуры кипения.
GH — конденсация пара
Дойдя до температуры кипения (в данном случае 100 градусов), пар начинает переходить в жидкое состояние. Этот процесс также происходит при постоянной температуре.
HI — охлаждение воды
Сконденсировавшись, вода охлаждается, пока не начнет замерзать.
IK — кристаллизация воды
Кристаллизуется (замерзает) вода при той же температуре, что и плавится лед — 0 градусов. Кристаллизация также происходит при постоянной температуре.
KL — охлаждение льда
После кристаллизации лед охлаждается.
С нагреванием и охлаждением все совсем просто — мы либо передаем теплоту телу (веществу), и оно идет на увеличение температуры, либо тело отдает тепло и охлаждается.
В остальных процессах температура не меняется. Это связано с тем, что количество теплоты не всегда зависит от температуры. Формулы для всех процессов выглядят так:
|
Нагревание Q = cm(tконечная − tначальная) Охлаждение Q = cm(tначальная − tконечная) Q — количество теплоты c — удельная теплоемкость вещества [Дж/кг · ˚C] m — масса tконечная — конечная температура tначальная — начальная температура |
|
Плавление Q = λm Кристаллизация Q = −λm Q — количество теплоты λ — удельная теплота плавления вещества [Дж/кг] m — масса |
|
Парообразование Q = Lm Конденсация Q = −Lm Q — количество теплоты L — удельная теплота парообразования вещества [Дж/кг] m — масса |
Онлайн-уроки физики в Skysmart не менее увлекательны, чем наши статьи!
Струнные сети
Каким состоянием вещества является космический вакуум? Большинство людей не задумываются об этом, но в последние десять лет Сяо Ган-Вэнь из Массачусетского технологического института и Майкл Левин из Гарварда предложили новое состояние вещества, которое могло бы привести нас к открытию фундаментальных частиц после электрона.
Путь к разработке модели струнно-сетевой жидкости начался в середине 90-х годов, когда группа ученых предложила так называемые квазичастицы, которые, казалось, появились в эксперименте, когда электроны проходили между двумя полупроводниками. Возник переполох, поскольку квазичастицы действовали так, будто бы обладали дробным зарядом, что казалось невозможным для физики того времени. Ученые проанализировали данные и предположили, что электрон является не фундаментальной частицей Вселенной и что существуют фундаментальные частицы, которых мы пока не обнаружили. Эта работа принесла им Нобелевскую премию, но позже выяснилось, что в результаты их работы закралась ошибка в эксперименте. О квазичастицах благополучно забыли.
Но не все. Вэнь и Левин взяли за основу идею квазичастиц и предложили новое состояние вещества, струнно-сетевое. Основным свойством такого состояния является квантовая запутанность. Как и в случае с неупорядоченной сверходнородностью, если вы с близкого расстояния взглянете на струнно-сетевое вещество, оно будет похоже на неупорядоченный набор электронов. Но если взглянуть на него как на цельную структуру, вы увидите высокую упорядоченность из-за квантово-запутанных свойств электронов. Вэнь и Левин затем расширили свою работу, чтобы охватить другие частицы и свойства запутанности.
Проработав компьютерные модели для нового состояния вещества, Вэнь и Левин обнаружили, что концы струн-сетей могут производить разнообразные субатомные частицы, включая легендарные «квазичастицы». Еще большим сюрпризом стало то, что при вибрации струнно-сетевого вещества оно делает это в соответствии с уравнениями Максвелла, отвечающими за свет. Вэнь и Левин предположили, что космос наполнен струнными сетями запутанных субатомных частиц и что концы этих струн-сетей представляют собой субатомные частицы, которые мы наблюдаем. Также они предположили, что струнно-сетевая жидкость может обеспечивать существование света. Если космический вакуум заполнен струнно-сетевой жидкостью, это может позволить нам объединить свет и материю.
Все это может показаться очень надуманным, но в 1972 году (за десятки лет до струнно-сетевых предложений) геологи обнаружили в Чили странный материал — гербертсмитит. В этом минерале электроны образуют треугольные структуры, которые, похоже, противоречат всему, что мы знаем о взаимодействии электронов друг с другом. Кроме того, эта треугольная структура была предсказана в рамках струнно-сетевой модели, и ученые работали с искусственным гербертсмититом, чтобы точно подтвердить модель.
Твердое тело
Тело, находящееся в твердом состоянии, не меняет форму и объем. В твердые тела могут превращаться тела, ранее существовавшие в других агрегатных состояниях, при низких температурах. Твердые тела можно разделить на два вида: кристаллические (имеют кристаллическую решетку) и аморфные (частным случаем аморфного состояния является стеклообразное состояние).
Рис. 1. Кристаллические и аморфные тела.
В аморфных телах, в отличие от кристаллических, атомы колеблются около хаотично расположенных точек
Твердые тела характеризуются тем, что молекулы внутри таких веществ сохраняют свое положение неизменным (т. е. практически не движутся).
Твердые тела
 Твердые тела сохраняют форму и объем
Твердые тела сохраняют форму и объем
С твердыми телами все очень просто. Они окружают нас повсюду: столы, стулья, машины, дома, растения, предметы в классе и т.д. Согласись, что форма твердого тела не меняется даже после того, как мы его передвинем, переставим или спрячем в сумку либо карман. Конечно, приложив определенную силу, твердое тело можно разбить или сломать, тем самым изменить его форму, но сами по себе такие изменения вряд ли произойдут.
Ртуть
Ртуть — это, наверное, самый удивительный и необычный химический элемент. Это единственный металл, который при комнатной температуре находится в жидком состоянии. При температуре -38,8°С ртуть кристаллизуется, т.е. становится твердой, а когда температура достигает 356,7°С — начинает кипеть.
Ртуть по праву считается одним из семи металлов древности, о котором человечеству стало известно как минимум 3500 лет назад. За подвижность, блеск и цвет Аристотель назвал ртуть живым серебром. В древней медицине она применялась как компонент различных мазей и других лекарств: «живое серебро» использовали для лечения кожных болезней. В настоящее время ртуть в медицинских целях практически не используют из-за очень высокой токсичности паров этого вещества, но ее успешно применяют в электротехнике, химической промышленности, электронике.

До сих пор ртуть используется для изготовления медицинских термометров. Ее удобство заключается в том, что, достигнув определенной температурной отметки, столбик не опускается, а остается на прежнем уровне.
Одно и то же вещество в разных состояниях
Тело образуют молекулы вещества, которое в разных условиях находятся в каком-либо агрегатном состоянии. Стоит напомнить понятие «агрегатное» (изучается в 7 классе). Латинское слово «aggrego» означает «присоединяю». Под воздействием температуры и давления вещество представляется в одном из состояний:
Есть еще одно, достаточно сложное состояние – плазма, но здесь более характерными являются не физические, а химические свойства.

Схема показывает соотношение потенциальной и кинетической энергий молекул внутри тела. В твердом состоянии характерно значительное превышение потенциальной энергии (Еп ˃˃ Ек) над кинетической. Поэтому молекулы движутся по-другому, не как в жидкости, где потенциальная энергия больше (Еп ˃ Ек), но не значительно. В случае с газом расстояния между молекулами велики, и энергия взаимодействия (потенциальная) на много меньше (Еп ˂˂ Ек) энергии движения (кинетической).
Движение частиц в твердом веществе затруднено, поэтому молекулы лишь колеблются или вращаются около одного места, а движения по всему телу нет. Это создает внутренний порядок, неизменную форму, постоянный объем, прочность. Существуют кристаллические (к примеру, поваренная соль, алмаз, золото) и аморфные (многие пластмассы, стекло, смола и др.) вещества. Молекулы в таких состояниях образуют системы, похожие на решетки: кристаллические решетки имеют правильную форму (одинаковые расстояния и равные углы), аморфные решетки – неправильную форму (расстояния различны и углы различны).
Когда молекулы еще хорошо контактируют, но структура решеток частично нарушается – это уже жидкость. Упорядоченность частиц уменьшается, но все же ее больше, чем в газе. Жидкость – состояние промежуточное между газообразным и твердым.
Газ или пар обычно рассматривается одинаково. Здесь далекие друг от друга, быстрые молекулы создают сильно разреженную систему частиц. В газе очень большие скорости и незначительные силы взаимодействия частиц. Поэтому между молекулами существует много свободного пространства, что приводит во-первых к стремлению газа занимать большие объемы, а во-вторых, наоборот легко сжиматься.
Уравнения химических реакций
Вещества, состав которых отражают химические формулы, могут участвовать в химических процессах (реакциях). Графическая запись, соответствующая данной химической реакции, называется уравнением химической реакции. Например, при сгорании (взаимодействии с кислородом) угля происходит химическая реакция:
Запись показывает, что один атом углерода С, соединяясь с одной молекулой кислорода O2, образует одну молекулу углекислого газа СО2. Число атомов каждого химического элемента до и после реакции должно быть одинаково! Это правило — следствие Закона сохранения массы вещества: масса исходных веществ равна массе продуктов реакции. Закон был открыт в 18-м веке М. В. Ломоносовым и, независимо от него, А. Л. Лавуазье.
Выполняя этот закон, необходимо в уравнениях химических реакций расставлять коэффициенты так, чтобы число атомов каждого химического элемента не изменялось в результате реакции. Например, при разложении бертолетовой соли КClO3, получается соль КСl и кислород О2:
Число атомов калия и хлора одинаково, а кислорода — разное. Уравняем их:
Теперь изменилось число атомов калия и хлора до реакции. Уравняем их:
Теперь между правой и левой частями уравнения можно поставить знак равенства:
Полученная запись показывает, что при разложении двух молекул КClO3 получается две молекулы КСl и три молекулы кислорода O2. Число молекул показывают при помощи коэффициентов.
При подборе коэффициентов необязательно считать отдельные атомы. Если в ходе реакции не изменился состав некоторых атомных групп, то можно учитывать число этих групп, считая их единым целым:
Последовательность действий такова:
1. Определим валентность исходных атомов и группы PO4:
2. Перенесём эти числа в правую часть уравнения:
3. Составим химические формулы полученных веществ по валентностям составных частей:
4
Обратим внимание на состав «самого сложного» соединения: Ca3(PO4)2 и уравняем число атомов кальция (их три) и число групп РО4 (их две):
5. Число атомов натрия и хлора до реакции теперь стало равным шести; доставим соответствующий коэффициент:
Эти правила образуют Алгоритм составления уравнений химических реакций обмена, так как, пользуясь этой последовательностью, можно уравнять схемы многих химических реакций, за исключением более сложных окислительно-восстановительных реакций (см. урок 7).
Химические реакции бывают разных типов. Основными являются:
1. Реакции соединения:
Здесь из двух и более веществ образуется одно вещество:
2. Реакции разложения:
Здесь из одного вещества получаются два вещества и более веществ:
3. Реакции замещения:
Здесь реагируют простое и сложное вещества, образуются также простое и сложное вещества, причём простое вещество замещает часть атомов сложного вещества:
4. Реакции обмена:
Здесь реагируют два сложных вещества и получаются два сложных вещества. В ходе реакции сложные вещества обмениваются своими составными частями:
Существуют и другие типы химических реакций.
Задание 1.5. Расставьте коэффициенты в предложенных выше примерах.
Задание 1.6. Расставьте коэффициенты и определите тип химической реакции:
Основные газовые законы
Состояние газа характеризуется его объемом, давлением и температурой. Между этими величинами экспериментально были установлены следующие законы:
- Закон Бойля-Мариотта (изотермический) сокращенно записывается так:
- при Т = const
- Р 1 · V 1 = Р 2 · V 2 , или Р · V = const;
- Закон Гей-Люссака (Изобарный)
- при Р = const
- V 1 / T 1 = V 2 / T 2 , или V / T = const.
- Закон Шарля (Изохорный)
- при V = const
- Р 1 / T 1 = Р 2 / T 2 , или Р / T = const.
Все три закона можно объединить в один универсальный газовый закон , который описывается уравнением Клапейрона:
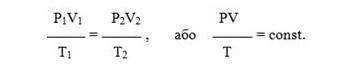
Зависимость для одного моля газа была выведена Менделеевым, поэтому называется уравнением Менделеева-Клапейрона. Оно содержит постоянную величину -универсальную газовую постоянную R.
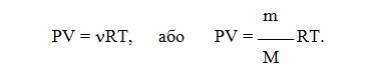

Расчеты значений универсальной газовой постоянной R
Закон сохранения массы веществ
(М.В.Ломоносов, 1748 г.; А.Лавуазье, 1789 г.)
Масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Атомно-молекулярное учение этот закон объясняет следующим образом: в результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка (т.е. химическое превращение- это процесс разрыва одних связей между атомами и образование других, в результате чего из молекул исходных веществ получаются молекулы продуктов реакции). Поскольку число атомов до и после реакции остается неизменным, то их общая масса также изменяться не должна. Под массой понимали величину, характеризующую количество материи.
Исходя из закона сохранения массы, можно составлять уравнения химических реакций и по ним производить расчеты. Он является основой количественного химического анализа.
Газообразное агрегатное состояние
Большинство газов бесцветны и прозрачны, а потому невидимы. Его присутствие мы можем почувствовать при дуновении ветра, сквозняка в комнате или же на примере простых опытов (рисунок 7).
Рисунок 7. Иллюстрация опыта, подтверждающего наличие воздуха в окружающем нас пространстве
Опустим в воду воронку, предварительно соединив ее резиновой трубкой со стеклянной трубочкой. Из трубочки начнут выходить пузырьки воздуха, которые до этого были в воронке и во всей системе в целом. Подобные простые опыты подтверждают наличие воздуха вокруг нас.
Каково расположение молекул газа? Молекулы газа находятся на больших расстояниях друг от друга и в постоянном хаотичном движении. Поэтому часто взаимодействие между молекулами газа не учитывается, и большое пространство между частицами позволяет сильно сжимать газы. Молекулярное строение газа представлено на рисунке 8.
Рисунок 8. Молекулярное строение газа (паров воды)
{"questions":[{"content":"Сопоставьте свойства объема и формы в соответствии с <b>агрегатными состояниями</b>.`matcher-1`","widgets":{"matcher-1":{"type":"matcher","labels":,"items":}}}]}
Диаграмма состояния сплавов, образующих химические соединения
Сплавы, представляющие собой химическое соединение компонентов А и В, имеют сложную диаграмму состояния. Химическое соединение обозначают АmВn, т.е. в соединении на m атомов компонента А приходится n атомов компонента В. Химические соединения представляют собой сложное соединение с одной точкой плавления, в отличие от сплавов, у которых таких точек две.
В данной системе различают три фазы:
- жидкий раствор;
- твердый раствор компонента В в компоненте А (фаза α) (рис. 6);
- твердый раствор компонента А в компоненте В (фаза β).
Эта диаграмма как бы составлена из диаграмм для двух систем:
- компонент А — химическое соединение АmВn;
- компонент В — химическое соединение АmВn.
В сплавах левее точки С компонента А больше, чем входит
в химическое соединение АmВn. В этих сплавах левее точки промежуточного состояния образуется эвтектика α + АmВn. В сплавах правее точки С компонента В больше, чем может
входить в химическое соединение АmВn. В этих сплавах образуется эвтектика АmВn+ β.
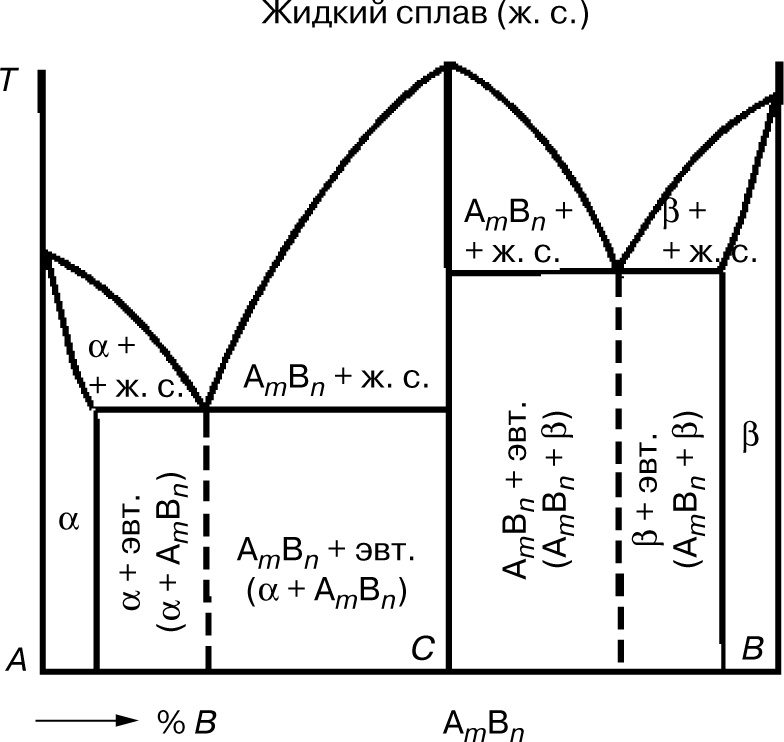
Между составом и структурой сплава, определяемой типом, диаграммой состояния и свойствами сплава, существует определенная зависимость (правило Н.С. Курнакова). В механических смесях свойства (твердость Н, электропроводность Е, вязкость, хрупкость и др.) изменяются линейно. В твердых растворах свойства изменяются по криволинейной зависимости. В химических соединениях свойства выражаются ломаными линиями.
При концентрации, соответствующей химическому соединению, отмечается характерный перелом на кривой свойств, так как химические соединения обладают индивидуальными свойствами, отличающимися от свойств компонентов. По диаграммам можно определять и технологические свойства сплавов, что облегчает выбор материала для изготовления изделий.
Металлы Яна — Теллера
Металлы Яна — Теллера — это новейшее дитя в мире состояний вещества, поскольку ученым удалось успешно создать их впервые лишь в 2015 году. Если эксперименты подтвердятся другими лабораториями, эти металлы могут изменить мир, так как они обладают свойствами как изолятора, так и сверхпроводника.
Ученые во главе с химиком Космасом Прассидесом экспериментировали, вводя рубидий в структуру молекул углерода-60 (в простом народе известных под фуллеренами), что приводило к тому, что фуллерены принимают новую форму. Этот металл назван в честь эффекта Яна — Теллера, который описывает, как давление может изменять геометрическую форму молекул в новых электронных конфигурациях. В химии давление достигается не только за счет сжатия чего-то, но и за счет добавления новых атомов или молекул в ранее существовавшую структуру, изменяя ее основные свойства.
Когда исследовательская группа Прассидеса начала добавлять рубидий в молекулы углерода-60, молекулы углерода изменялись от изоляторов к полупроводникам. Тем не менее из-за эффекта Яна — Теллера молекулы пытались остаться в старой конфигурации, что создавало вещество, которое пыталось быть изолятором, но обладало электрическими свойствами сверхпроводника. Переход между изолятором и сверхпроводником никогда не рассматривался, пока не начались эти эксперименты.
Интересно в металлах Яна — Теллера то, что они становятся сверхпроводниками при высоких температурах (-135 градусов по Цельсию, а не при 243,2 градуса, как обычно). Это приближает их к приемлемым уровням для массового производства и экспериментов. Если все подтвердится, возможно, мы будем на шаг ближе к созданию сверхпроводников, работающих при комнатной температуре, что, в свою очередь, произведет революцию во многих отраслях нашей жизни.
Плавится или отвердевает
На примере воды всегда можно наблюдать переходные процессы в веществе. Вода удобна для исследований, так как не нужно создавать специальные сложные условия для опытов. Увидеть плавление и отвердевание можно на улице осенью или весной.
 Тает снег
Тает снег
Весной, когда наступает пора солнечных дней, температура воздуха может быть положительной. А если измерить температуру тающего снега, то она будет равной 0оС, пока весь снег в этом месте не растает. Происходит это следующим образом.
Пусть на улице 5 градусов мороза. Воздух, все предметы вокруг и снег – все имеет температуру -5оС. Весенний воздух и все вокруг нагревается. При достижении нуля градусов воздух и окружающие тела продолжают нагреваться, а снег – нет. Он начинает таять, то есть плавиться. Все тепло, поглощаемое снегом, идет не на рост его внутренней энергии и повышение температуры, а на разрыв связей, которые держат кристаллическую решетку. Решетка постепенно разрушается, идет плавление снега. В нем уже есть частично вода, но еще много твердых частей снега. Похоже это на кашеобразную массу. Вот почему иногда говорят: «Снег сегодня сырой». Пока весь снег не растает, температура этой смеси будет 0оС. И как только вода полностью заменит снег, она, как и все окружающее, начнет под действием солнечных лучей нагреваться.
 Первый лед на лужах
Первый лед на лужах
Осенью, когда температура опускается до 0оС, на лужах образуется первый лед. Вода переходит в твердое состояние. Такой процесс называют отвердеванием или кристаллизацией. А теперь — важный момент. Если температура окружающего воздуха будет понижаться, то количество льда станет больше и лужа застынет до самого дна. Но, пока вся вода в луже не превратится в лед, температура льда и воды останется 0оС. Почему так?
При снижении окружающей температуры вода выделяет (отдает) тепло. Внутренняя энергия соответственно становится меньше. В этой ситуации молекулы начинают объединяться в кристаллическую решетку, происходит отвердевание. В луже есть одновременно и лед, и вода. Пока эта смесь не превратится чисто в лед, тепло будет выделяться наружу, частицы, потерявшие энергию, «будут строить решетку», то есть устанавливать межмолекулярные связи.
Как только лед заполнит всю лужу, его температура начнет снижаться и станет такой же, как и все окружающие предметы.
Кристаллические решетки у веществ различны, соответственно и разрушаются или создаются эти решетки в разных условиях, при разных температурах.
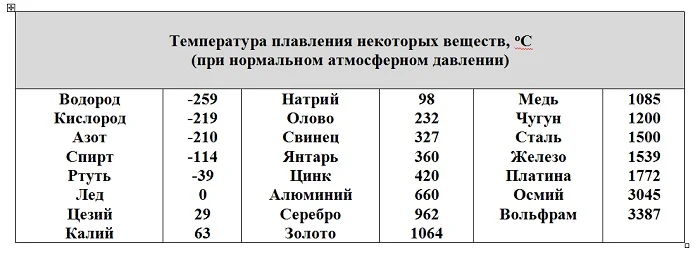
По таблице свободно находится ответ на классический вопрос: можно ли расплавить в серебряной ложке медь и олово? Олово – можно, его температура плавления, 232 градуса, меньше, чем у серебра. Медь расплавить нельзя. Серебро расплавится раньше, чем медь. У серебра температура плавления 962 градуса, а у меди – 1085о С.
 Олово в серебряной ложке Источник
Олово в серебряной ложке Источник
Еще одно интересное сравнение, результаты которого применяются в измерении температуры воздуха. В уличных термометрах используется подкрашенный спирт. Его температура плавления, а значит и кристаллизации -114оС. Значит, спирт в стеклянном столбике прибора будет находиться в жидком виде. Ртуть же имеет температуру кристаллизации -39оС. На севере планеты или в Сибири зимние температуры бывают гораздо ниже. Достигнув -39оС, ртуть в термометре затвердеет и стеклянная трубочка лопнет, прибор испортится. Поэтому используется спиртовой термометр.
В настоящее время жизнь человека немыслима без изделий, полученных путем плавления. Цветная и черная металлургия опираются на процесс плавления и отвердевания. Они же лежат в основе технологий литья деталей машин, металлической и пластиковой посуды, прорезиненной обуви и многого другого.
 Изготовление слитка золота Работа со стеклом
Изготовление слитка золота Работа со стеклом
Интересен старый пример из жизни сельчан, который помогает сохранить бочки, ведра, бидоны, наполненные водой, от разрывания льдом.
 Деревянный кол в бочке с водой
Деревянный кол в бочке с водой
Уезжая со своего участка, многие дачники вставляют в бочку с водой деревянный кол. Им хочется оставить запас воды до следующего приезда. Если дело происходит осенью, то велика вероятность, что в течение недели вода застынет. Кол не позволит разорваться бочке. На ней не будет даже трещин. Объясняется это тем, что присутствие в жидкости посторонних твердых тел облегчает процесс кристаллизации. Эти тела становятся центрами кристаллизации, вокруг которых начинают образовываться кристаллы. В данном случае центром будет кол. Первый лед появится именно на нем, а другие кристаллы начнут к нему прилипать, оттягиваясь от стенок бочки. Поэтому на бочку будет оказано минимальное давление, которое не способно ее испортить.
Точка плавления
Физические агрегатные состояния веществ способны переходить с одного вида в другие — из твердых в жидкие, из жидких в газообразные при изменении их температуры. Изменение температуры ведет к увеличению или к уменьшению кинетической энергии. Переход твердого вещества в жидкое называют плавлением.
Границу перехода из твердого состояния в жидкое задает так называемая точка плавления с температурой, способной возбудить кинетическую энергию в частице, которой будет достаточно, чтобы отделиться от своего стационарного положения кристаллической решетки. Чем больше температура, тем больше передаваемая кинетическая энергия частицам элемента. Чем сильнее сила притяжения между частицами, тем больше необходимо создать кинетической энергии для высвобождения частиц из кристаллической решетки.
К примеру, железо необходимо нагреть до 1538 С для того, чтобы оно начало плавиться, а тугоплавкий вольфрам — до 3422 С.
Во время литья расплавленное (раскаленное добела) железо выливается в приготовленную форму.

При температуре ниже 1535 С железо затвердевает, принимая вид литейной формы.
Температура плавления вещества зависит от сил притяжения составляющих его частиц.
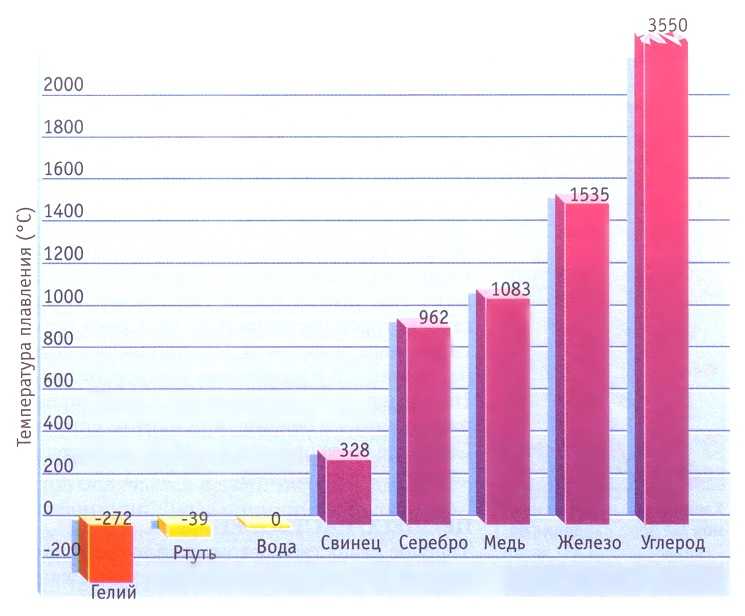
Для гелия эти силы настолько малы, что он становится твердым при давлении по крайней мере в 25 раз выше атмосферного.
Диаграмма состояний сплавов, образующих механические смеси из чистых компонентов
Диаграммы состояния — показатели фазового состояния сплавов в зависимости от температуры и концентрации компонентов. Диаграммы состояния строят для условий равновесия, т.е. такого состояния сплава, которое достигается при очень малых скоростях охлаждения или длительном нагреве. Диаграммы состояния сплавов в равновесном состоянии являются теоретическими диаграммами, так как истинное равновесие в практических условиях достигается редко.
Рассмотрим диаграмму состояний одного из сплавов, образующих механические смеси из чистых компонентов, системы «висмут — кадмий» (рис. 4).
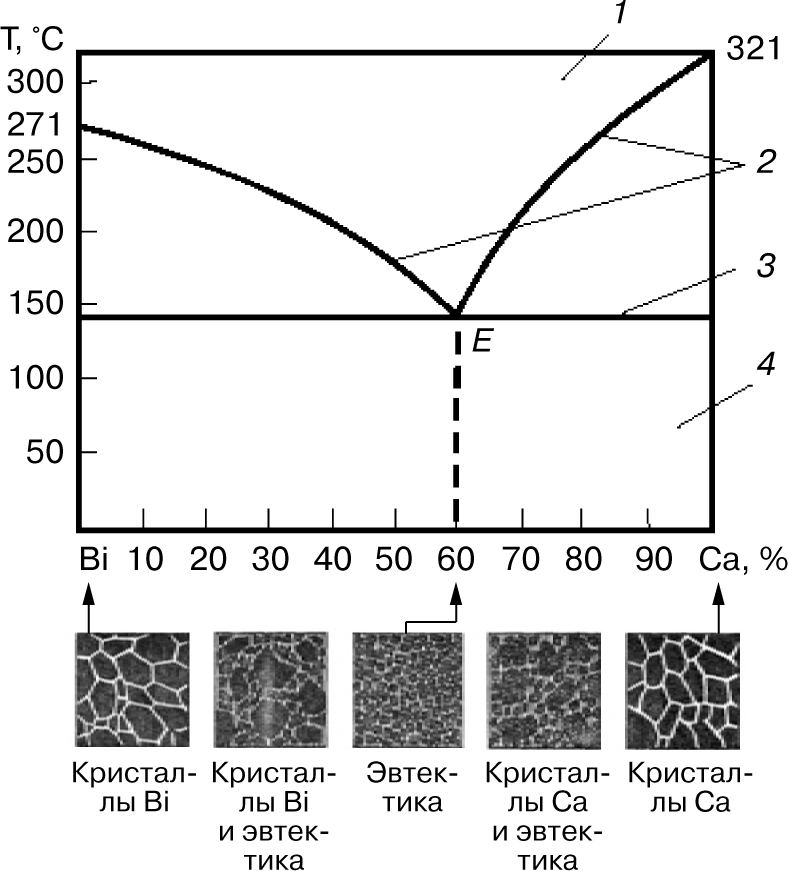
Область существования жидкого расплава ограничена сверху ломаной линией, соединяющей точки плавления висмута и кадмия через точку Е. В точке Е сплав (40% висмута и 60% кадмия) имеет одинаковые температуры ликвидуса и солидуса. Все остальные сплавы системы затвердевают и плавятся в пределах температурного интервала, который снизу ограничен горизонтальной линией солидуса. Сплав в точке Е имеет очень мелкие кристаллы висмута и кадмия, находящиеся в определенном взаимном расположении. Этот сплав называется эвтектикой, что в переводе с греческого означает легко плавящийся. Эвтектика — это механическая смесь двух (или более) видов кристаллов, одновременно кристаллизующихся из жидкого сплава. Твердые сплавы, лежащие левее эвтектической точки Е, и сплавы, содержащие до 40% висмута, называют доэвтектическими, а лежащие правее точки Е и содержащие более 40% висмута — заэвтектическими. Доэвтектические сплавы состоят из смеси кристаллов висмута и эвтектики (кристаллы висмута + кристаллы кадмия), а заэвтектические — из смеси кристаллов кадмия с эвтектикой.
По этому типу диаграммы состояния кристаллизуются также сплавы систем Zn—Sn, Pb—Ag, Ni—Cr, Cr—Mn, Cu—Bi, Al—Si.
Закон постоянства состава
Сущность закона постоянства состава (Пруст, 1801 г.) заключается в том, что каждое химическое соединение независимо от способа и условий ее добычи имеет определенный массовый состав.
Соотношение между массами элементов, входящих в состав определенной соединения, являются постоянными и не зависят от способа получения этого соединения.
Этот закон не имеет абсолютного обобщенного характера, поскольку в природе существует два типа соединений — с постоянным и с переменным составом.
Соединения, которые имеют постоянный состав и целочисленное атомное соотношение компонентов, называются Дальтониды .
К ним относятся вещества, которые в обычных условиях находятся в газообразном (СО2 , NH3 , NO, HCl) или жидком (Н2О, С6Н6) состоянии или могут быть легко переведены в них, а также кристаллические вещества с молекулярной структурой (I2 , лед).
Соединения переменного состава, в которых стехиометрические соотношения компонентов не соответствуют целым числам, называются бертоллидами .
Бертоллиды не имеют молекулярной структуры. К ним относится подавляющее большинство кристаллических соединений переходных d- и f- элементов: оксиды, гидриды, нитриды, сульфиды, карбиды и другие бинарные соединения. Следует заметить, что на постоянство состава влияет и изотопный состав, например, в обычной воде Н2О и в тяжелой воде D2О массовые доли кислорода различаются.
Итак, состав химических соединений зависит от типа химической связи, агрегатного состояния веществ, изотопного состава и условий их добычи и может быть как постоянным, так и переменным. Поэтому в настоящее формулировки закона постоянства состава внесены некоторые уточнения:
Об аморфности твёрдых веществ
ТВ являются аморфными, потому что они, как и кристаллические, способны достаточно долго сохранять форму. Однако через длительное время форма тел, образованная из таких веществ, меняется, что делает их похожими в этом отношении на жидкости. Так, установленная вертикально восковая свеча со временем утолщится в нижней части.
Можно попробовать проделать эту же процедуру с обычной жевательной резинкой или кусочком пластилина. Результат окажется тем же. Размягчение ускоряется пропорционально повышению температуры. Аморфные вещества, в отличие от кристаллических, не обладают определенной температурой плавления.
В аморфных веществах, как и в кристаллах, частицы, из которых они состоят, не распределены по всему объему. Частицы, составляющие аморфное вещество, расположены беспорядочно, и только ближние атомы или соседние молекулы расположены упорядоченно.
Как кусок горной породы, камень преимущественно содержит оксид кремния (IV), обладающий атомной кристаллической решеткой, поэтому он такой твердый. Тем не менее оксид кремния (IV) может быть не только кристаллическим ТВ, но и аморфным.