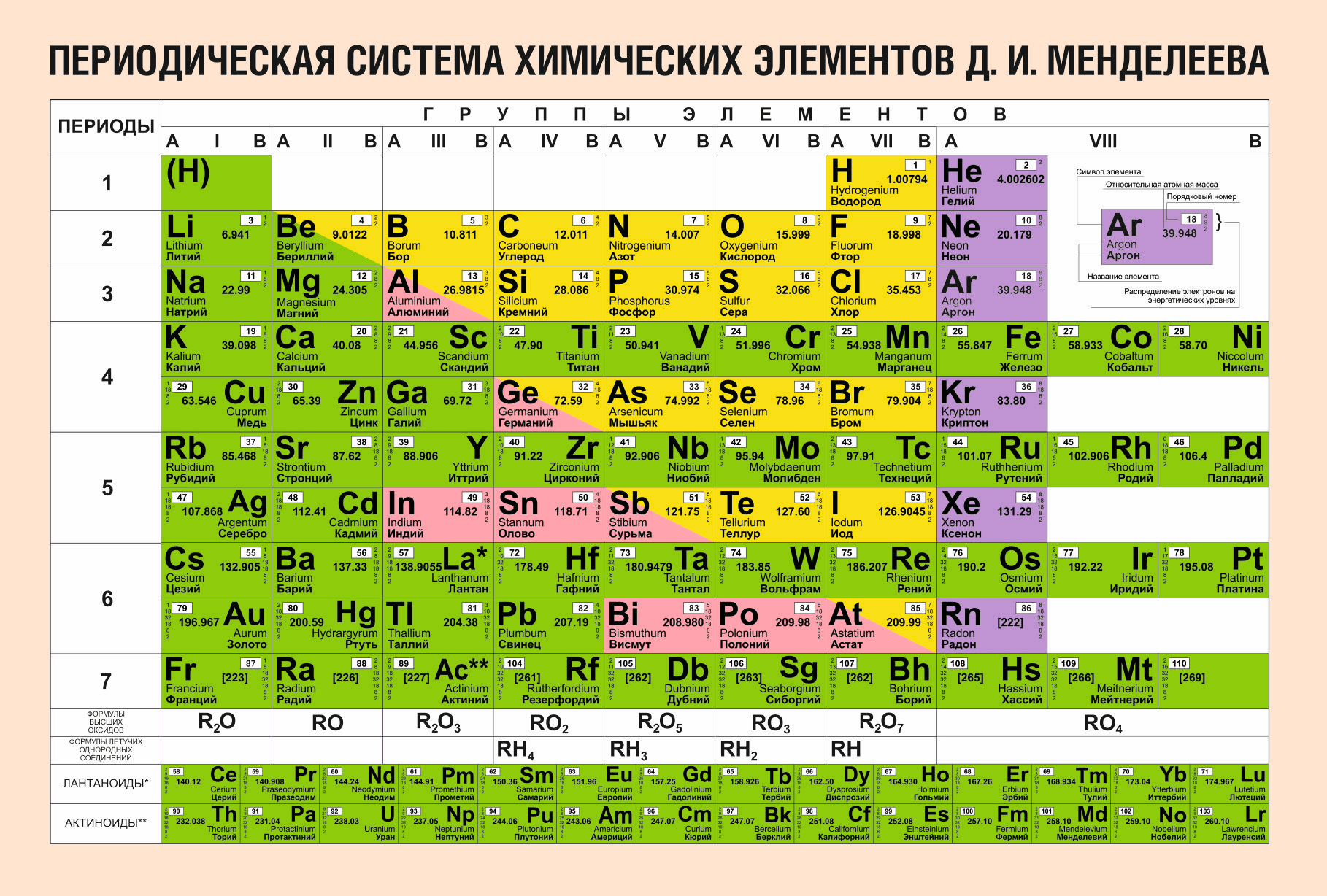
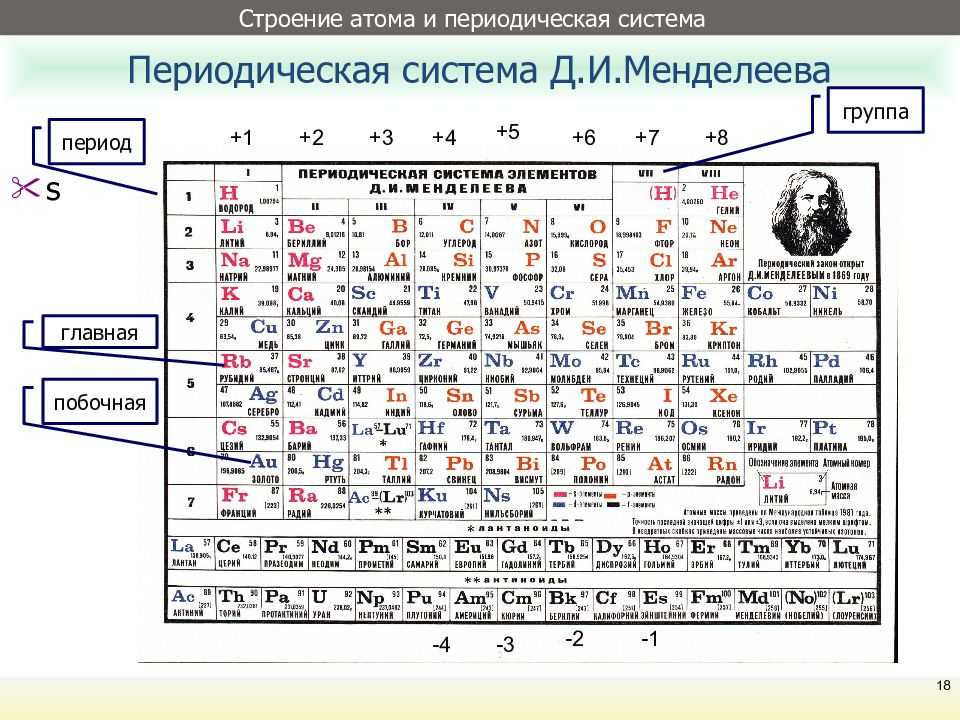
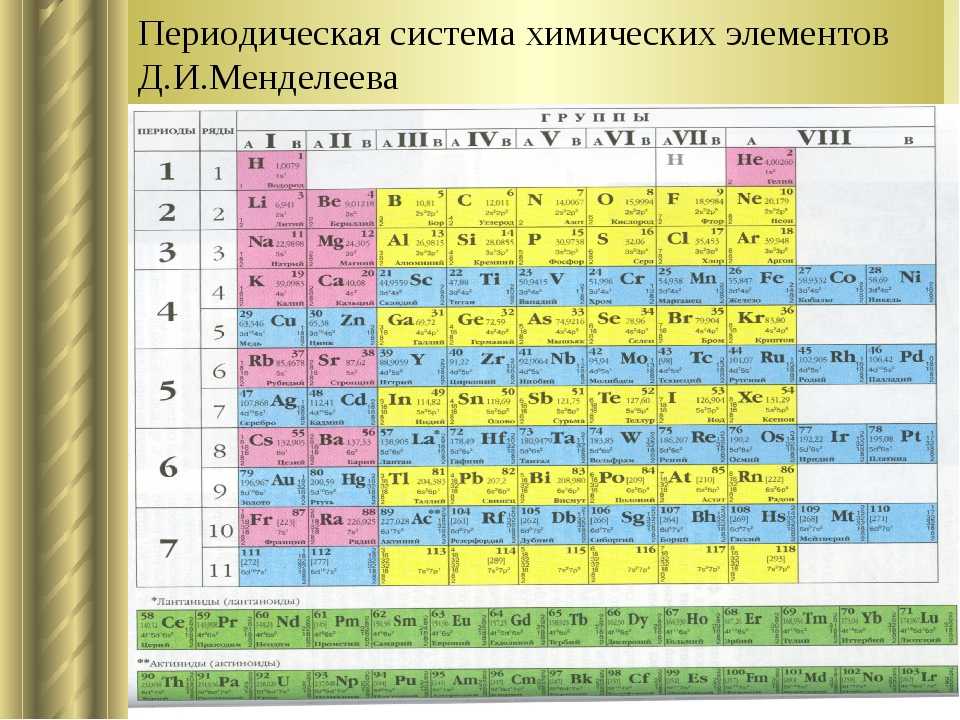
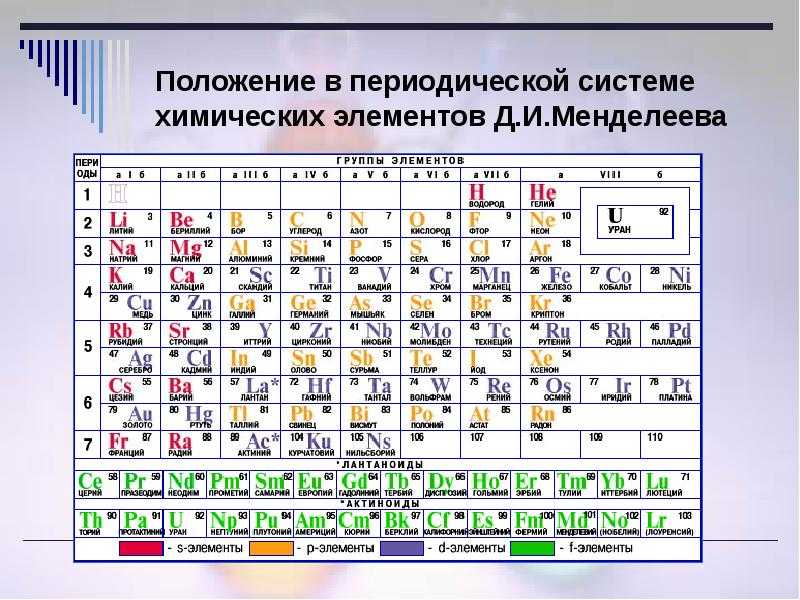
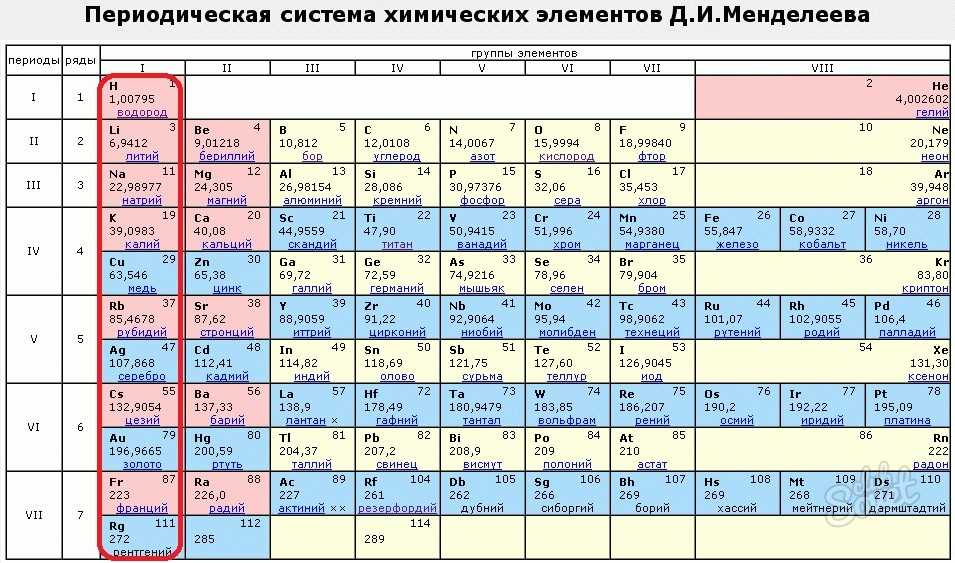
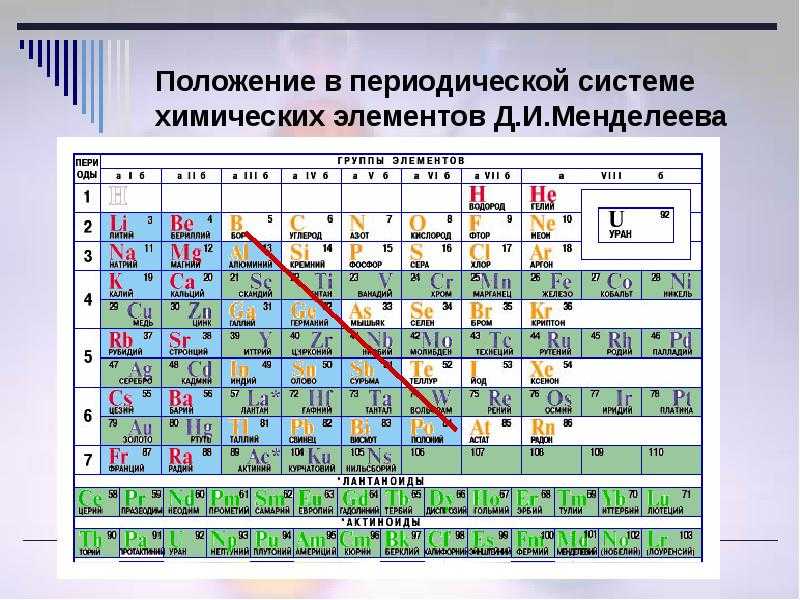
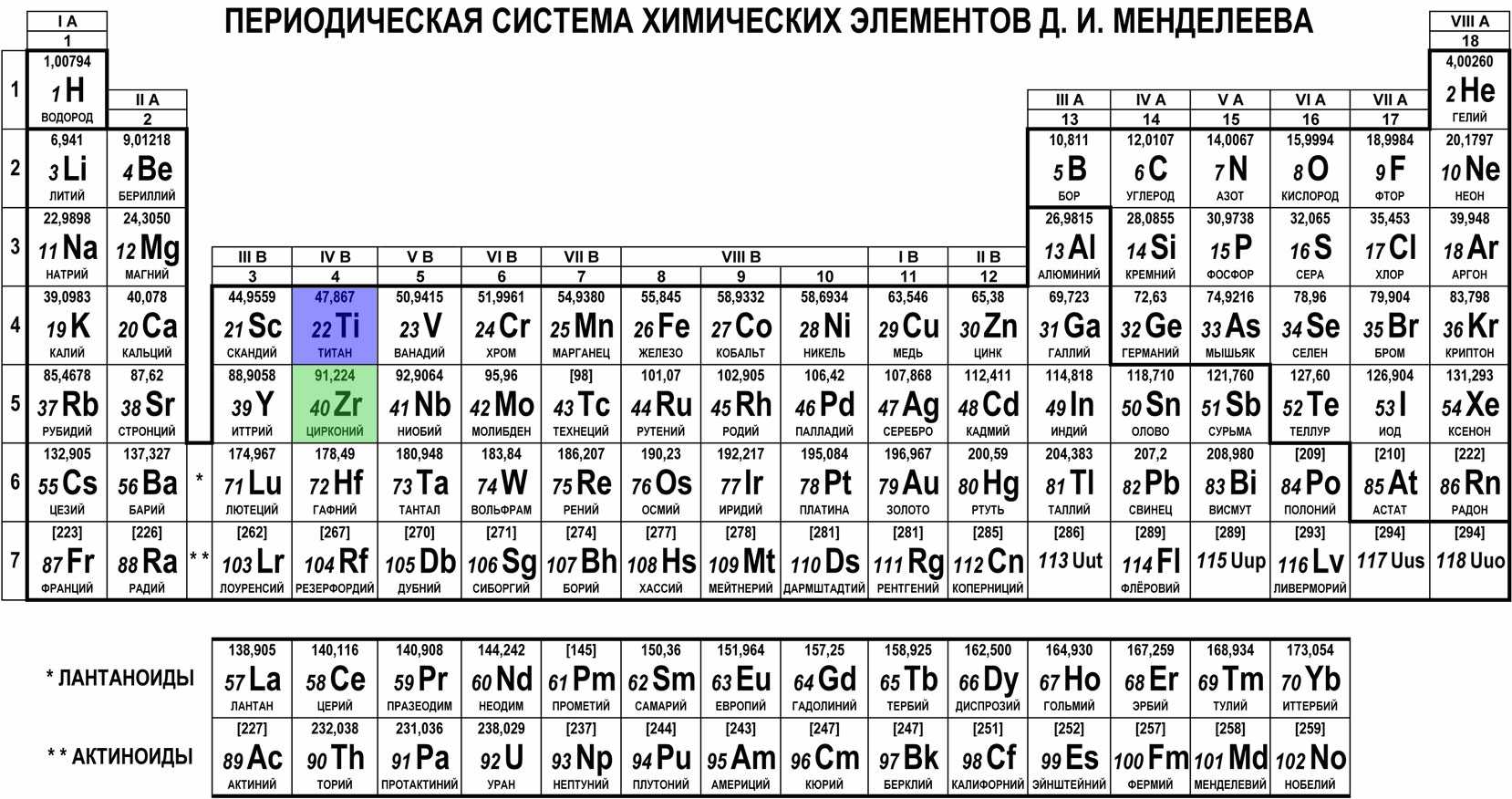
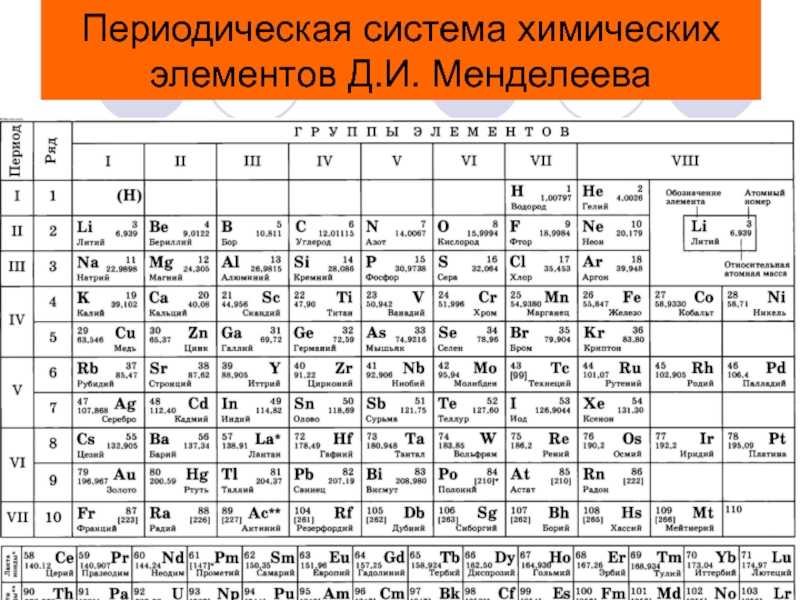
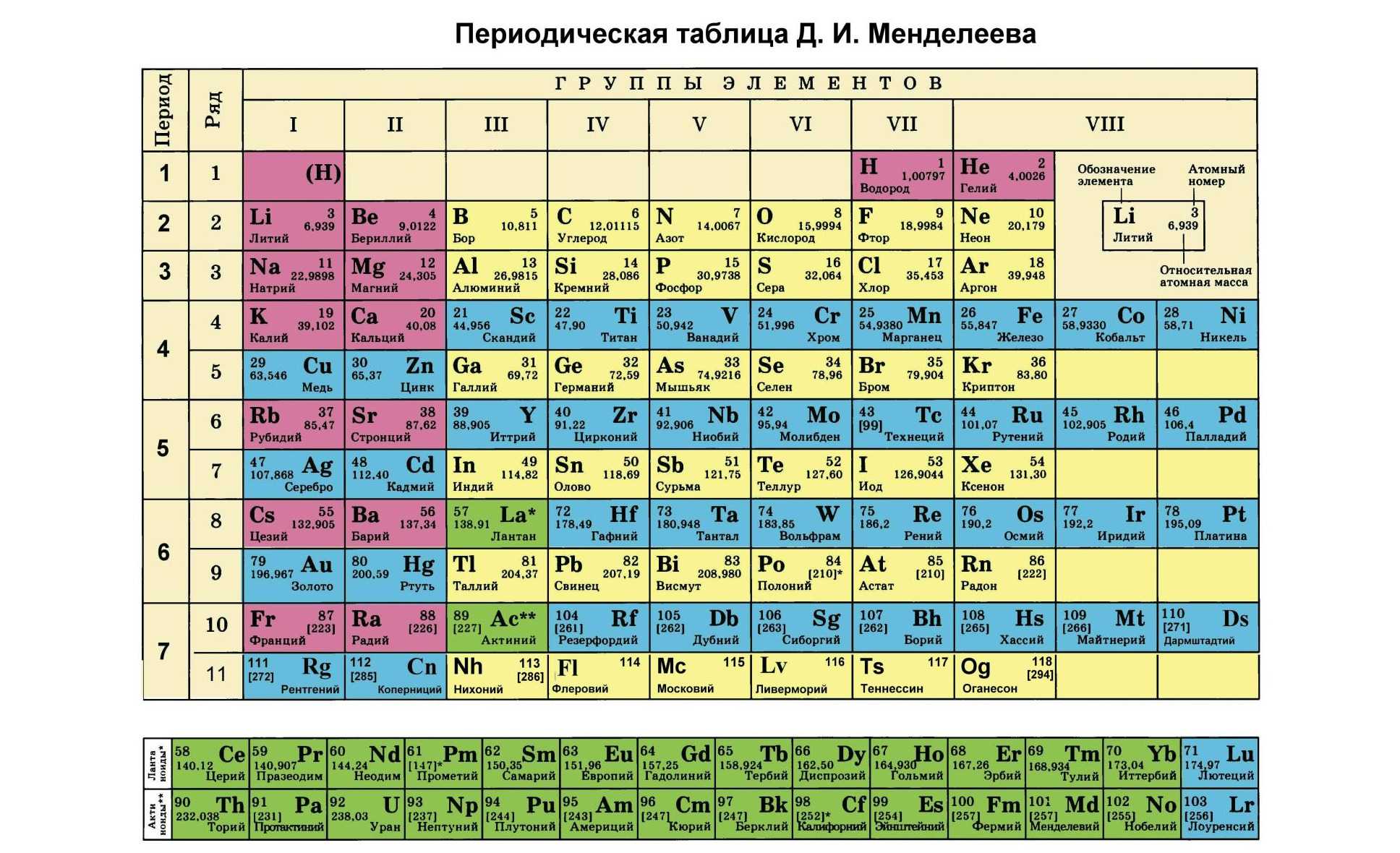
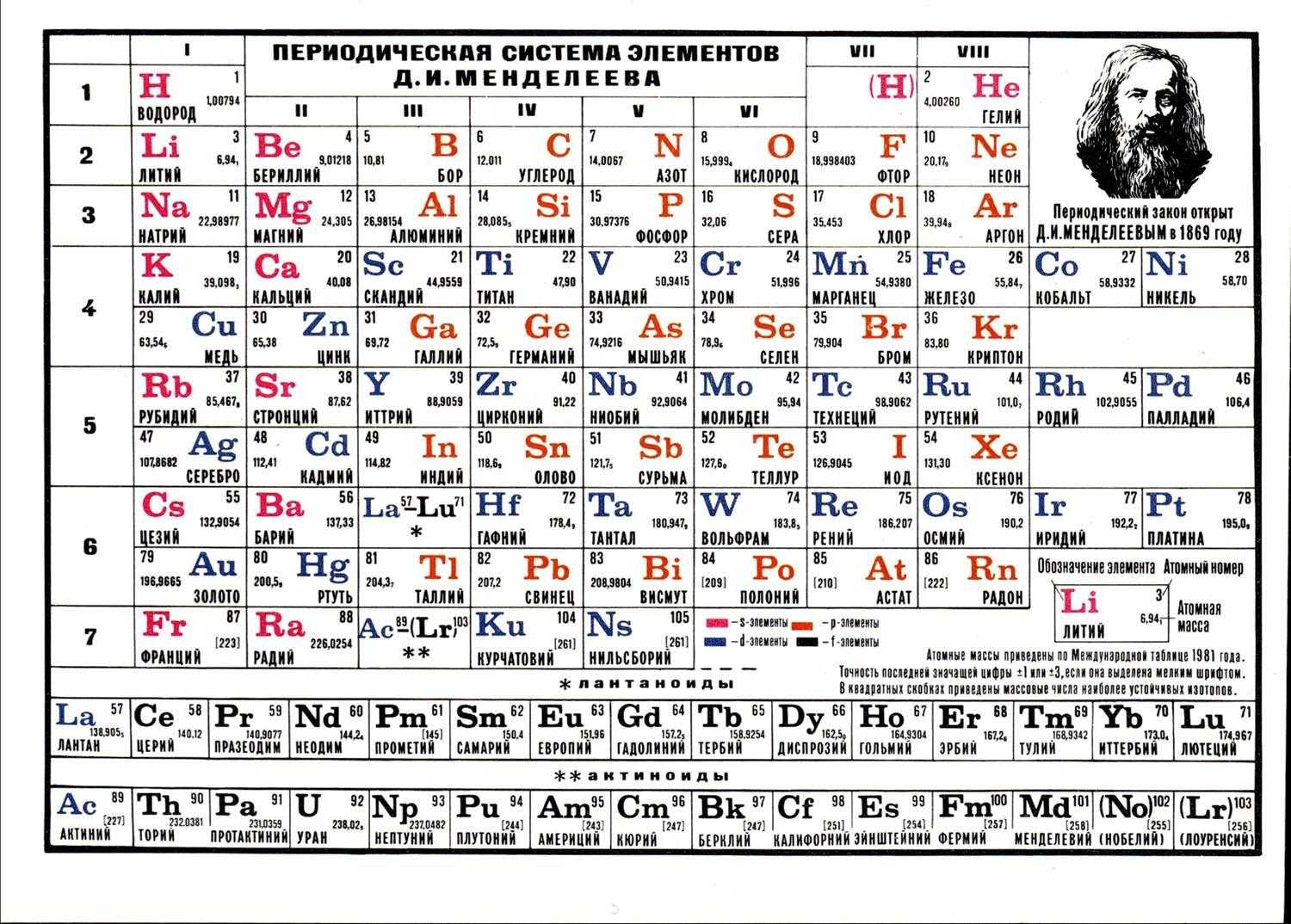
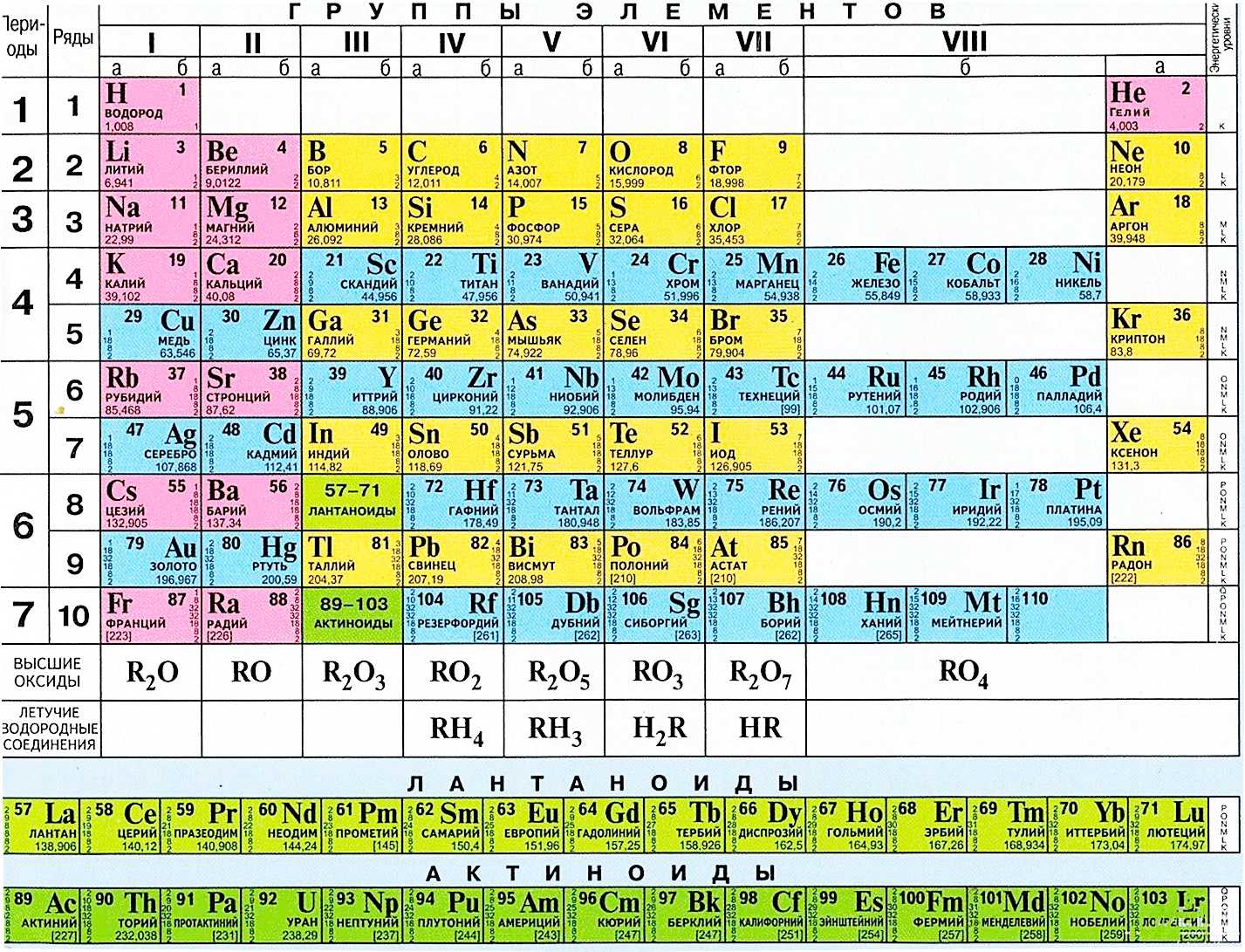
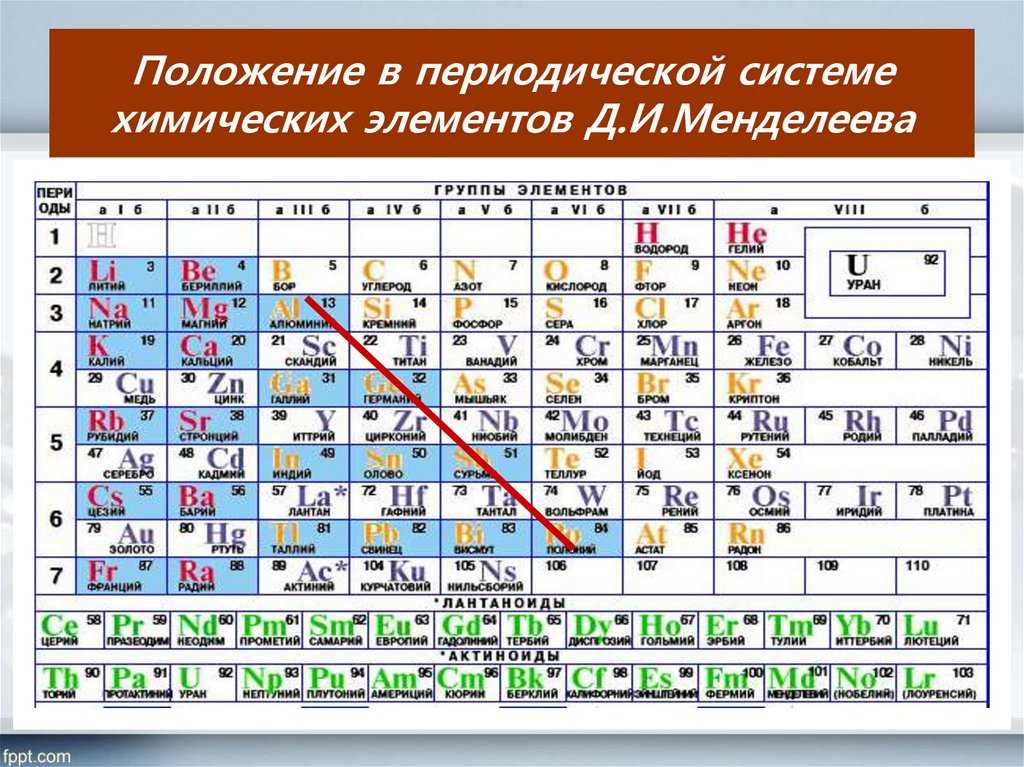
Таблица Менделеева с выделением главных и побочных подгрупп
Элементы главных подгрупп обозначены фиолетовым цветом, побочных — серым. Я напоминаю, что свойства элементов, находящихся в одной группе, но в разных подгруппах, отличаются достаточно сильно.
Например, натрий, калий, медь и серебро находятся в I группе: Na и K — в главной подгруппе, Cu и Ag — в побочной. Свойства натрия и калия весьма похожи — активные металлы, бурно реагирующие с водой, легко окисляющиеся на воздухе, имеют низкие температуры плавления и кипения. Все это сильно отличается от свойств меди и серебра: инертные металлы, которые не реагируют не только с водой, но и с большинством кислот, на воздухе устойчивы, температуры плавления и кипения достаточно высоки.
Еще ярче отличия заметны, например, в VI группе. Кислород, сера, селен (главная подгруппа) — типичные неметаллы, а хром, молибден и вольфрам, находящиеся в побочной подгруппе, относятся к металлам.
Все проблемы исчезают, если вы используете таблицы Менделеева: «мешанина» из элементов главных и побочных подгрупп исчезает, и мы начинаем отчетливо видеть логику периодического закона.
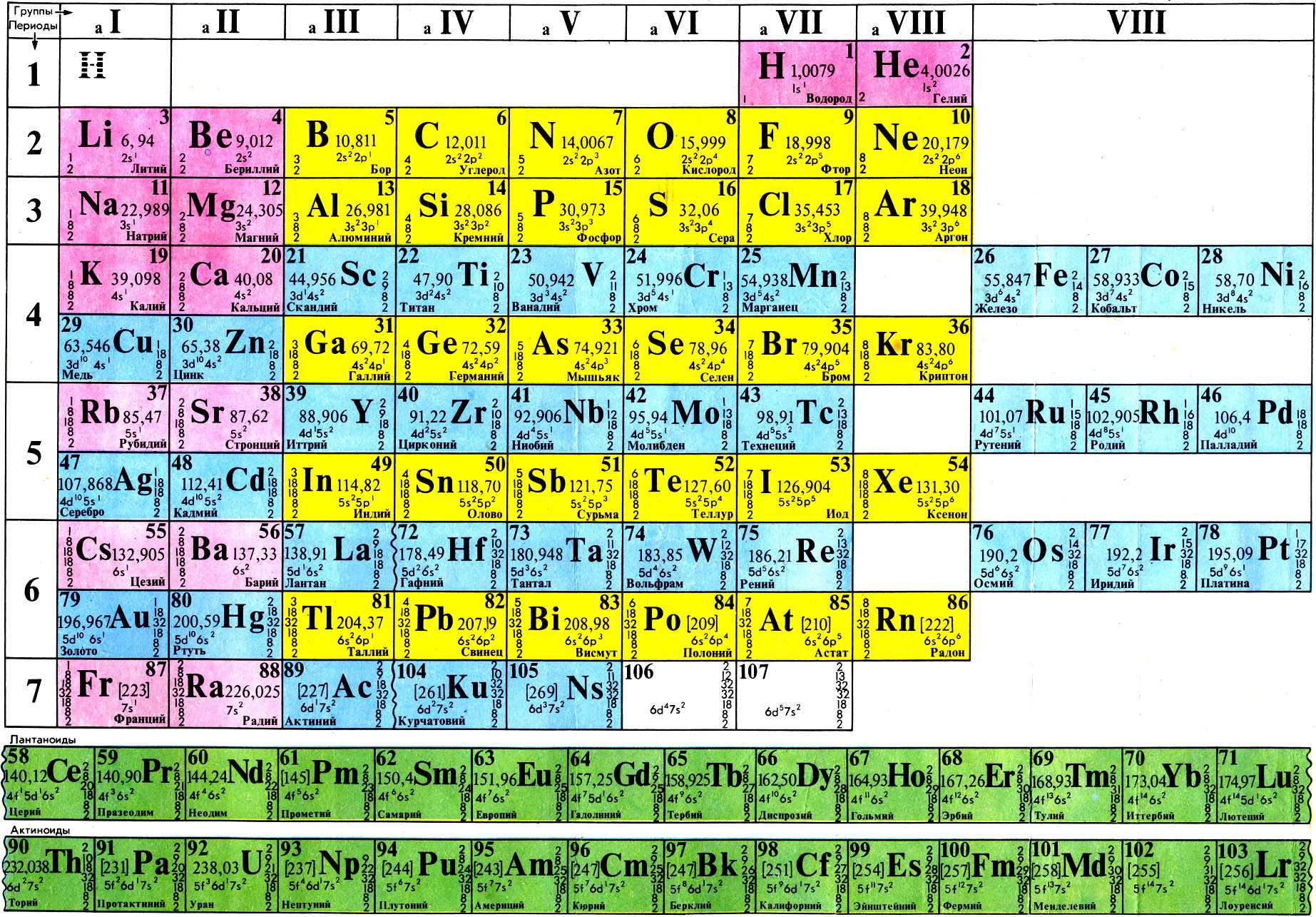
| Периоды | Группы элементов | |||||||||
| I | II | III | IV | V | VI | VII | VIII | |||
| 1 |
1 |
1 |
2 |
|||||||
| 2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
||
| 3 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
||
| 4 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
|
29 |
30 |
31 |
32 |
33 |
34 |
35 |
36 |
|||
| 5 |
37 |
38 |
39 |
40 |
41 |
42 |
43 |
44 |
45 |
46 |
|
47 |
48 |
49 |
50 |
51 |
52 |
53 |
54 |
|||
| 6 |
55 |
56 |
57 |
72 |
73 |
74 |
75 |
76 |
77 |
78 |
|
79 |
80 |
81 |
82 |
83 |
84 |
85 |
86 |
|||
| 7 |
87 |
88 |
89 |
104 |
105 |
106 |
107 |
108 |
109 |
110 |
| Высшие оксиды | R2O | RO | R2O3 | RO2 | R2O5 | RO3 | R2O7 | RO4 | ||
| Водородные соед. | RH4 | RH3 | H2R | HR |
| *Лантаноиды |
58 |
59 |
60 |
61 |
62 |
63 |
64 |
65 |
66 |
67 |
68 |
69 |
70 |
71 |
| ^Актиноиды |
90 |
91 |
92 |
93 |
94 |
95 |
96 |
97 |
98 |
99 |
100 |
101 |
102 |
103 |
Кто вообще такой Менделеев?
 “Трёхногий” портрет отца мировой химии
“Трёхногий” портрет отца мировой химии
Удивительно, что именно Менделеев стал родоначальником Периодического закона, ставшего основой периодической системы химических элементов.
Ставший 17-м ребенком директора Тобольской гимназии, он не проявлял призвания к какой-либо науке вплоть до старших курсов гимназии, однажды оставшись на второй год. Со временем ему удалось подтянуться и закончить Главный педагогический институт Петербурга с золотой медалью.
Став учителем в Одессе, он проявлял множество странных, нехарактерных для интеллигента того времени привычек и увлечений. Одним из них было увлечение кожевенным делом и шитьё: Менделеев самостоятельно переплетал книги, делал чемоданы и шил одежду для себя самого.
 Пороховые заводы Менделеева
Пороховые заводы Менделеева
В числе других его увлечений оказалось воздухоплавание, экономика и футурология. Попутно он создал основы современной метрологии, разработал первый ледокол. Занятие естественными науками приводило ученого то к созданию русского бездымного пороха, то к попытке разработки собственной теории эфира для объяснения свойств капиллярных сосудов.
Однако водка, несмотря на устоявшееся мнение, никак не связана с именем Менделеева. Водка родилась задолго до защиты диссертации «О соединении спирта с водой», посвященной на самом деле теории растворов (указал о необходимости учитывать химизм раствора), а не русскому национальному напитку.
 Менделеева совершил первый метеорологический полет в России
Менделеева совершил первый метеорологический полет в России
Но все же главное его открытие — Периодический закон: сегодня его относят к одному из фундаментальных законов мироздания, поскольку она до сих по является аксиоматической, абсолютной.
Это противоречит самим законам науки. Однако, правота Менделеева подтверждается раз за разом. И многое мы видим прямо за экраном своего монитора.
История создания Таблицы
Дмитрий Иванович Менделеев был не простым химиком, если кто-то так думает. Это был химик, физик, геолог, метролог, эколог, экономист, нефтяник, воздухоплаватель, приборостроитель и педагог. За свою жизнь ученый успел провести фундаментально много исследований в самых разных областях знаний. Например, широко распространено мнение, что именно Менделеев вычислил идеальную крепость водки – 40 градусов.
Не знаем, как Менделеев относился к водке, но точно известно, что его диссертация на тему «Рассуждение о соединении спирта с водой» не имела к водке никакого отношения и рассматривала концентрации спирта от 70 градусов. При всех заслугах ученого, открытие периодического закона химических элементов – одного их фундаментальных законов природы, принесло ему самую широкую известность.
 Д. И. Менделеев (1834-1907)
Д. И. Менделеев (1834-1907)
Существует легенда, согласно которой периодическая система приснилась ученому, после чего ему осталось лишь доработать явившуюся идею. Но, если бы все было так просто.. Данная версия о создании таблицы Менделеева, по-видимому, не более чем легенда. На вопрос о том, как была открыта таблица, сам Дмитрий Иванович отвечал: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово»
В середине девятнадцатого века попытки упорядочить известные химические элементы (известно было 63 элемента) параллельно предпринимались несколькими учеными. Например, в 1862 году Александр Эмиль Шанкуртуа разместил элементы вдоль винтовой линии и отметил циклическое повторение химических свойств.
Химик и музыкант Джон Александр Ньюлендс предложил свой вариант периодической таблицы в 1866 году. Интересен тот факт, что в расположении элементов ученый пытался обнаружить некую мистическую музыкальную гармонию. В числе прочих попыток была и попытка Менделеева, которая увенчалась успехом.
 Первоначальный вариант таблицы Менделеева
Первоначальный вариант таблицы Менделеева
В 1869 году была опубликована первая схема таблицы, а день 1 марта 1869 года считается днем открытия периодического закона. Суть открытия Менделеева состояла в том, что свойства элементов с ростом атомной массы изменяются не монотонно, а периодически.
Первый вариант таблицы содержал всего 63 элемента, но Менделеев предпринял ряд очень нестандартных решений. Так, он догадался оставлять в таблице место для еще неоткрытых элементов, а также изменил атомные массы некоторых элементов. Принципиальная правильность закона, выведенного Менделеевым, подтвердилась очень скоро, после открытия галлия, скандия и германия, существование которых было предсказано ученым.
Периодический закон
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде. Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д.И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов. Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему. Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».

Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
<<Форма демодоступа>>
Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.
Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.

Первый вариант Периодической таблицы элементов, составленной Д.И. Менделеевым.
Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий. Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку. Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов — теперь стало достаточно одного взгляда в таблицу.
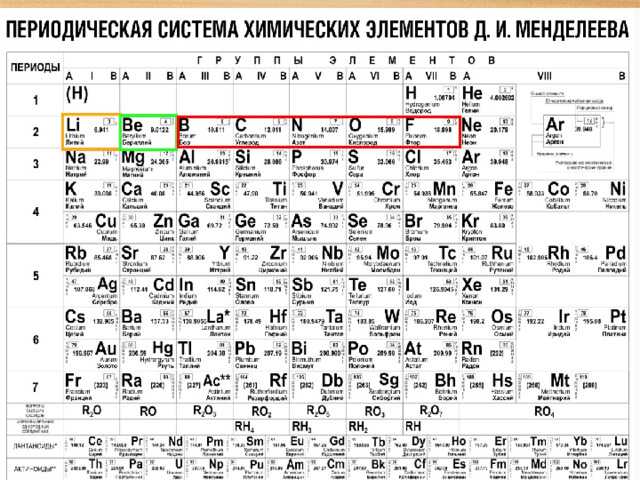
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ею пользоваться.
Характеристика элемента по его положению в периодической системе
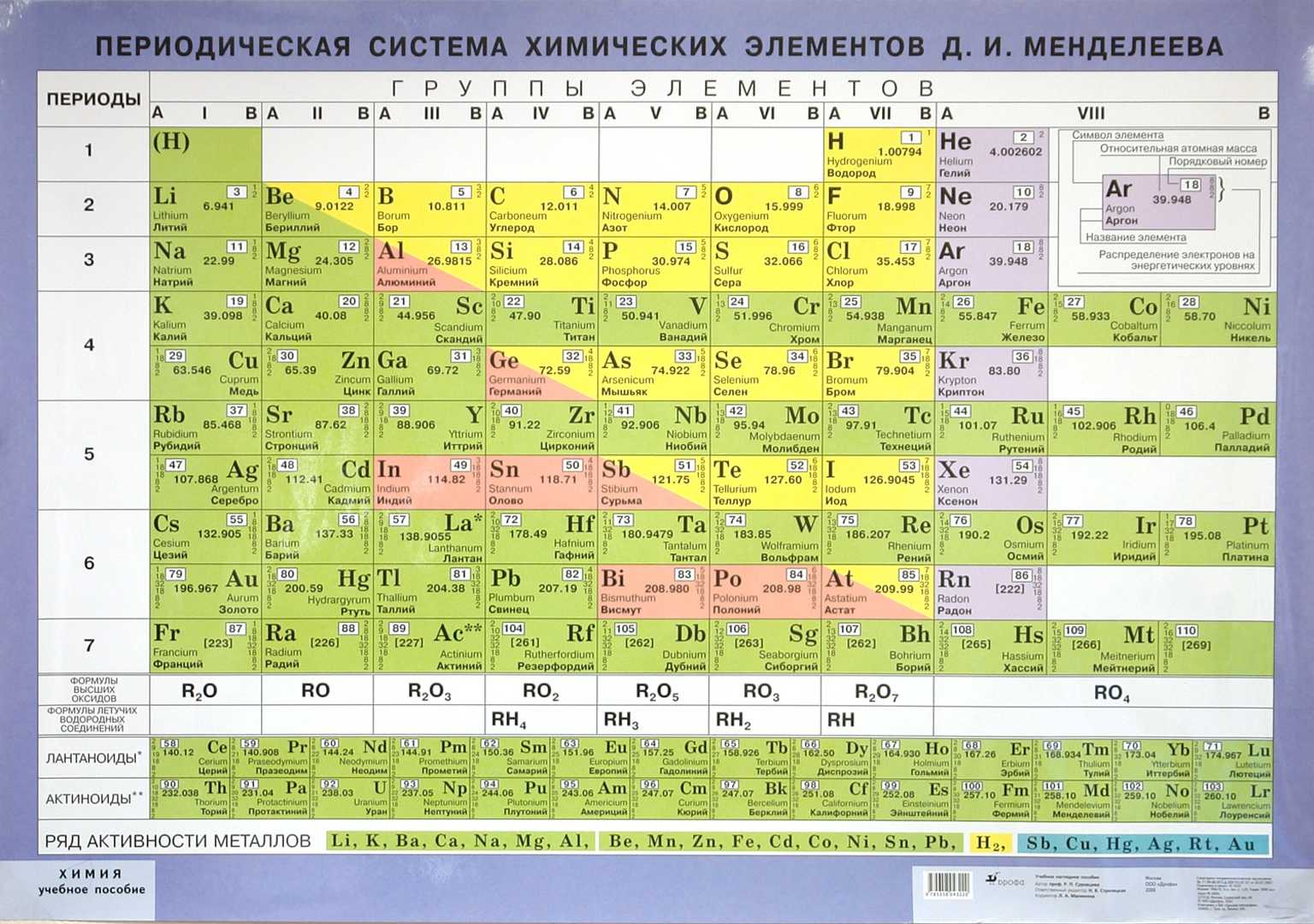
Зная «прописку» элементов в таблице, мы можем прогнозировать их свойства. Составим план, согласно которому сможем описать свойства элементов, рассматривать будем на примере серы.
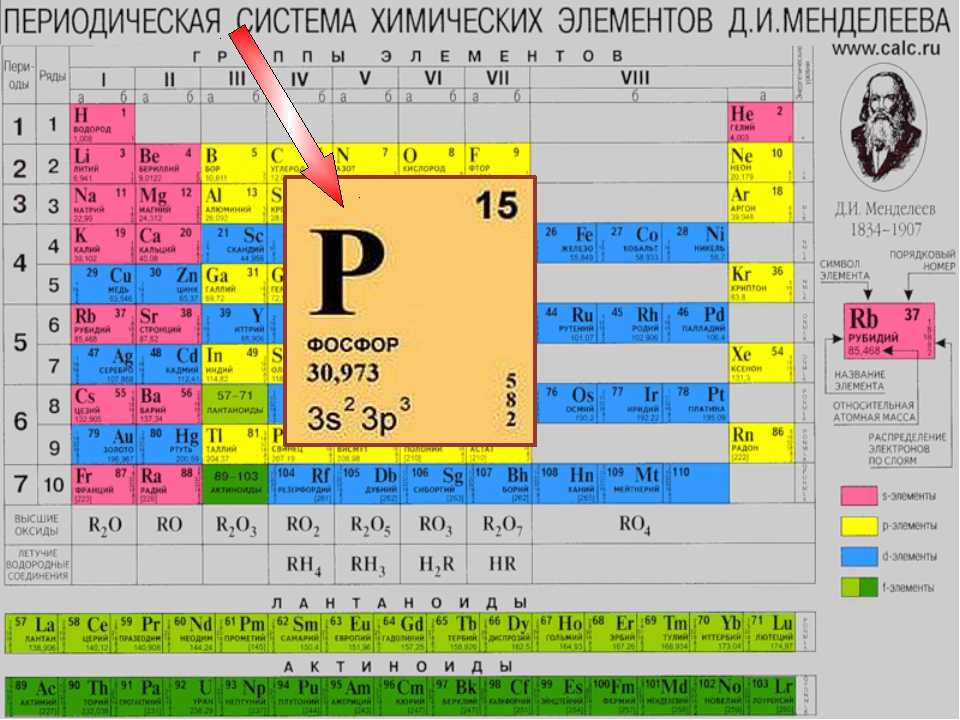
Первое, что нам необходимо знать — это какой символ имеет сера, чтобы по нему найти её в ПСХЭ. Обозначение S занимает ячейку 16. (порядковый номер).
Уточняем «прописку». III период, VI группа, главная подгруппа. Зная эти элементарные сведения, мы предполагаем, что это неметалл (принадлежность к VI группе и нахождение в малом ряду даёт нам основание для предположения).
Формула высшего оксида и его свойства. Поскольку сера элемент VI группы, высшая валентность будет равна VI. Формула оксида SO3. Пользуясь таблицей-шпаргалкой, определяем характер – кислотный. С курса физики известно, что противоположности притягиваются. Как плюс притягивает минус, так и кислотные оксиды взаимодействуют с основными, которые образованы элементами-металлами с валентностью I или II. Возьмём, например, барий, который образует оксид и гидроксид, соответственно ВаO и Вa(OH)2.
ВаO + SO3 → ВаSO4
Ва(ОН)2 + SO3 → ВаSO4 + H2O
Формула высшего гидроксида и его свойства. Снова обратимся к нашей шпаргалке, высшие гидроксиды VI группы имеют формулу H2ЭO4, а именно H2SO4. Образованный гидроксид имеет кислотные свойства, для которого свойственны реакции с основными оксидами и основаниями. К примеру, возьмём двухвалентный стронций, формула оксида и гидроксида соответственно SrO и Sr(OH)2.
SrO + H2SO4→ SrSO4 + H2O
Sr(OH)2 + H2SO4 → SrSO4 + 2H2O
Как элемент-неметалл образует летучее водородное соединение состава H2S.
На данном примере убеждаемся, что зная расположение элемента в ПСХЭ, можно прогнозировать его свойства, а также свойства веществ, в состав которых он входит.
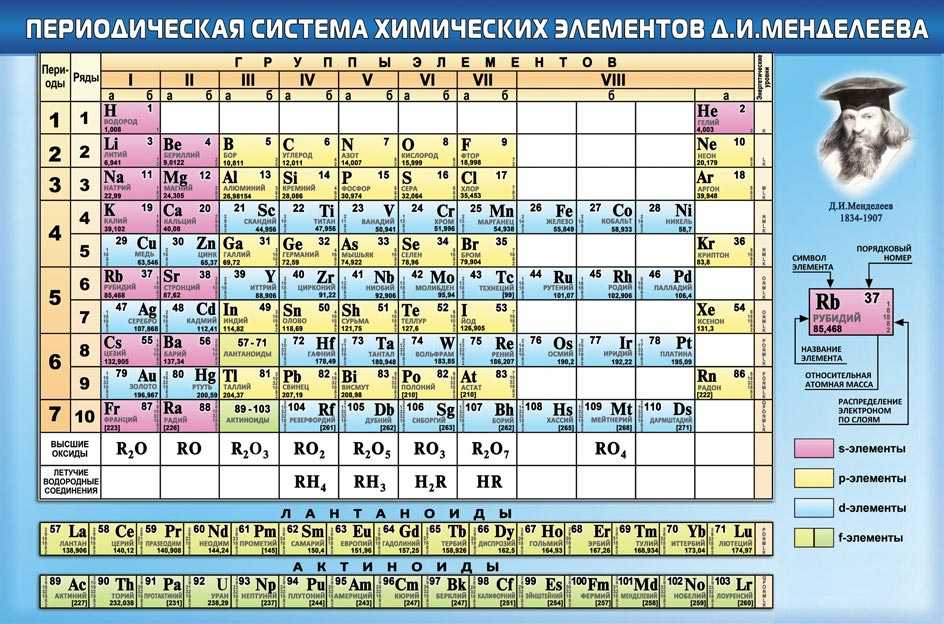
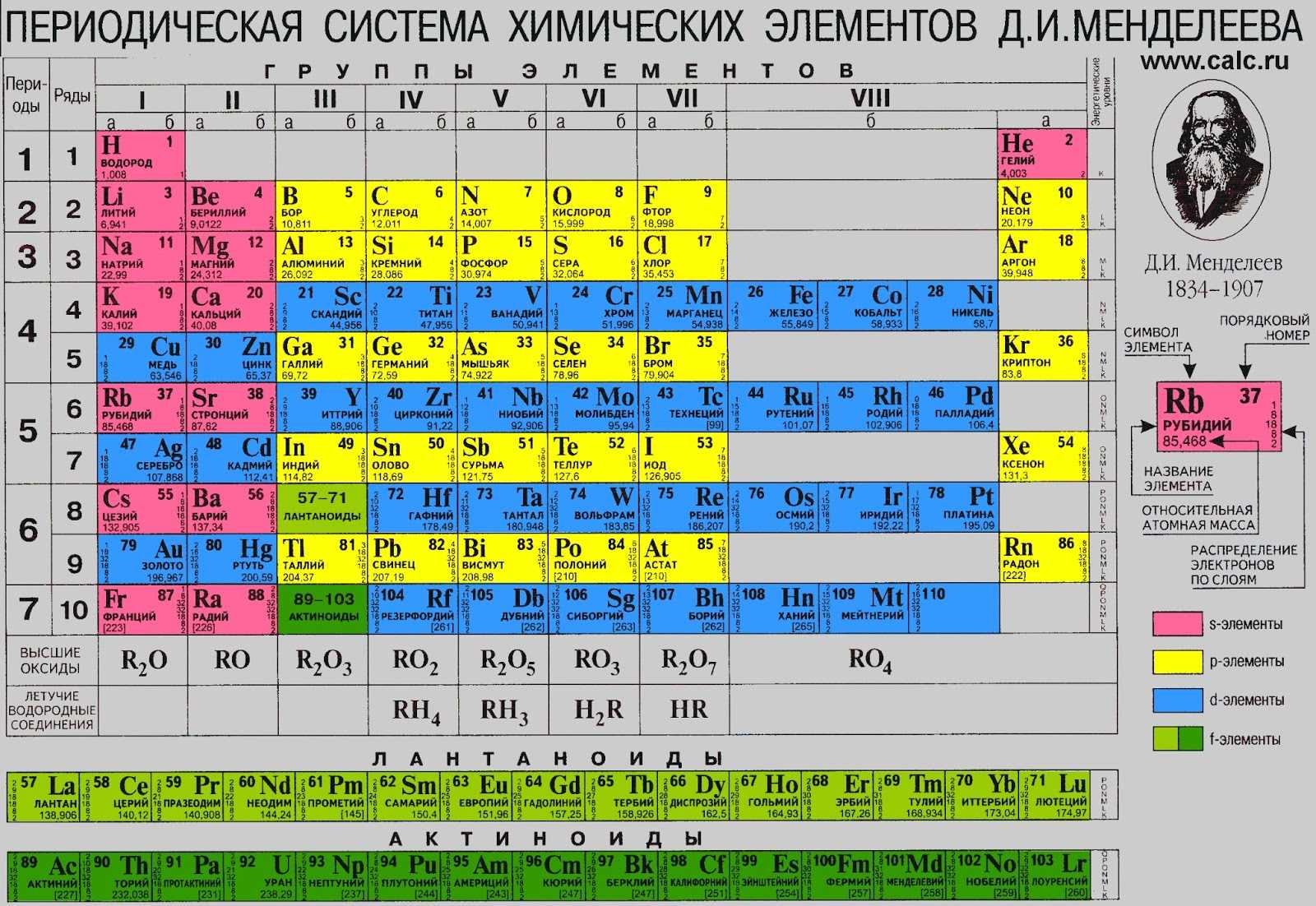
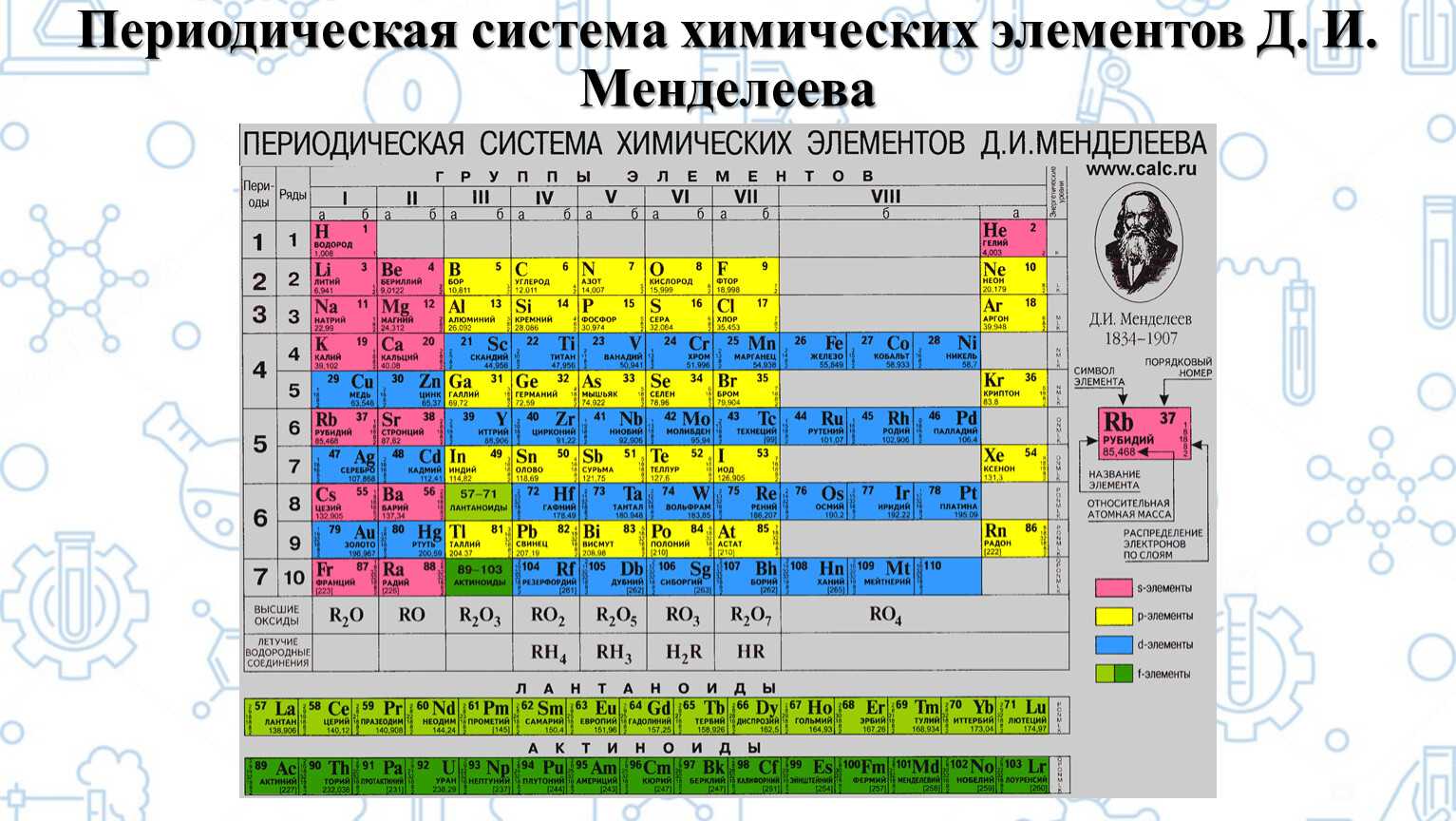
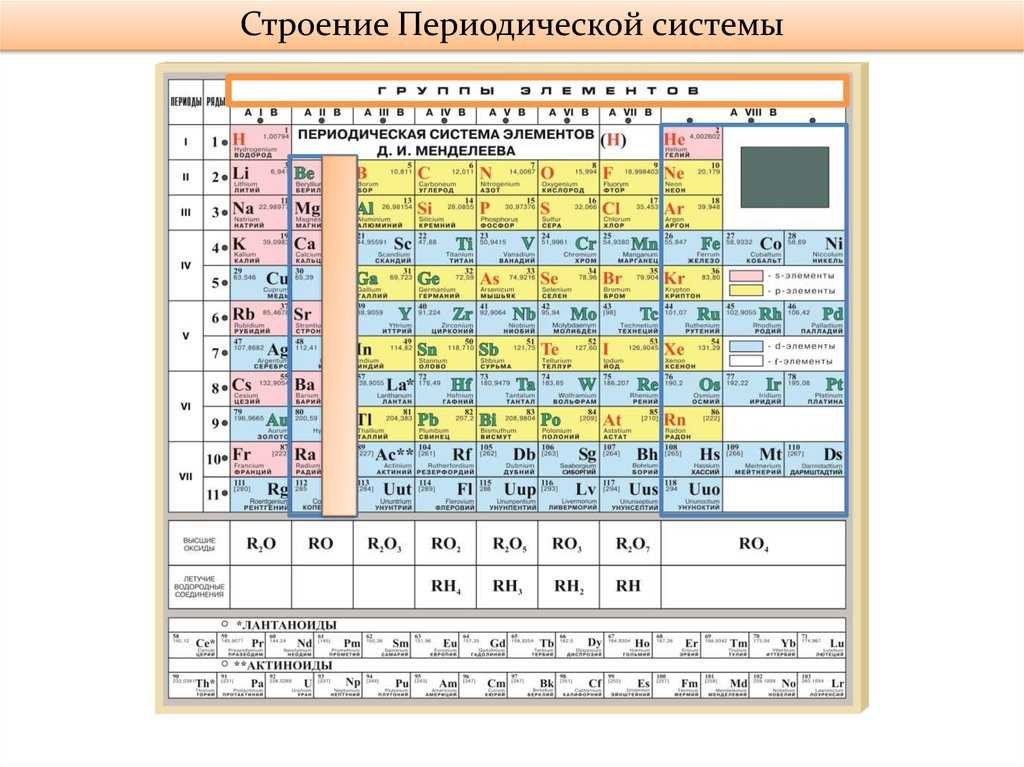
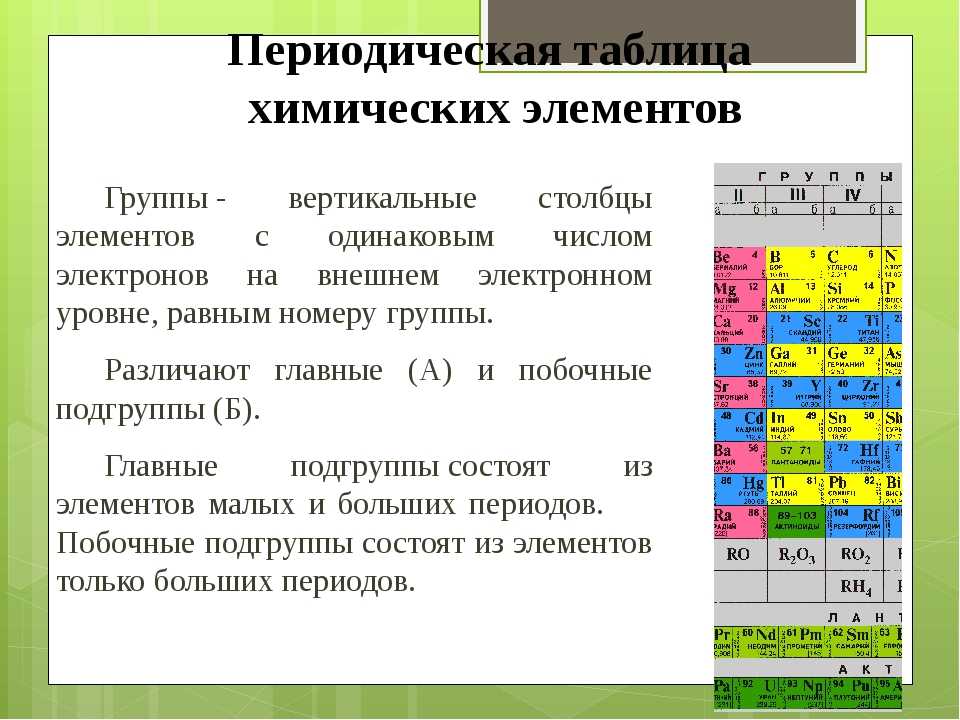
Структура периодической системы
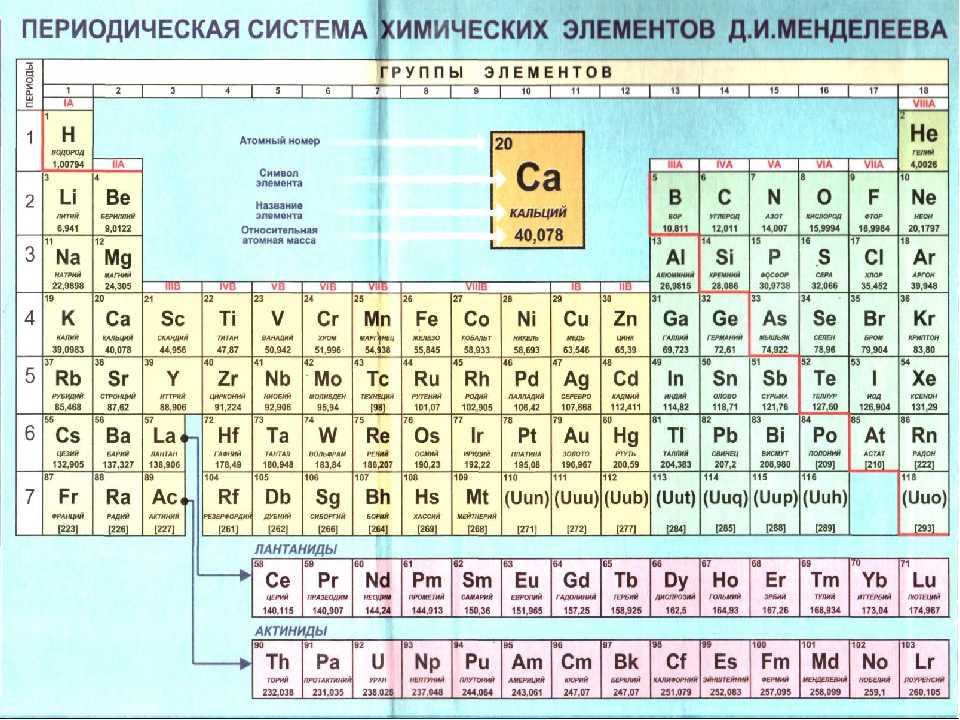
Периодическая система химических элементов Д. И. Менделеева является графическим отражением его же закона. Элементы расположены в таблице по определенному химическому и физическому смыслу. По расположению элемента можно определить его валентность, число электронов и многие другие особенности. Таблица поделена горизонтально на большие и малые периоды, а вертикально на группы.
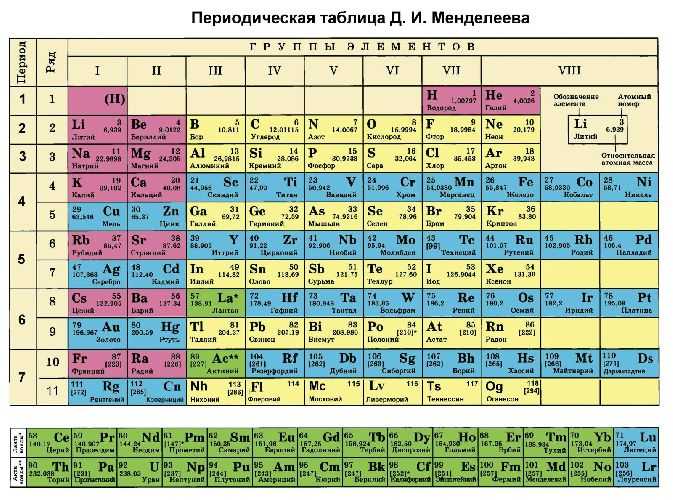 Рис. 2. Таблица Менделеева.
Рис. 2. Таблица Менделеева.
Существует 7 периодов, которые начинаются с щелочного металла, а заканчиваются веществами, имеющими неметаллические свойства. Группы, в свою очередь, состоящие из 8 столбцов, поделены на главные и побочные подгруппы.
Дальнейшее развитие науки показало, что периодическое повторение свойств элементов через определенные интервалы, особенно отчетливо проявляющиеся во 2 и 3 малых периодах, объясняется повторением электронного строения внешних энергетических уровней, где находятся валентные электроны, за счет которых идет образование химических связей и новых веществ в реакциях. Поэтому в каждом вертикальном столбце-группе оказываются элементы с повторяющимися характерными чертами. Это ярко проявляется в группах, где находятся семейства очень активных щелочных металлов (I группа, главная подгруппа) и неметаллов-галогенов (VII группа, главная подгруппа). Слева направо по периоду число электронов возрастает от 1 до 8, при этом имеет место уменьшение металлических свойств элементов. Таким образом, металлические свойства проявляются тем сильнее, чем меньше электронов на внешнем уровне.
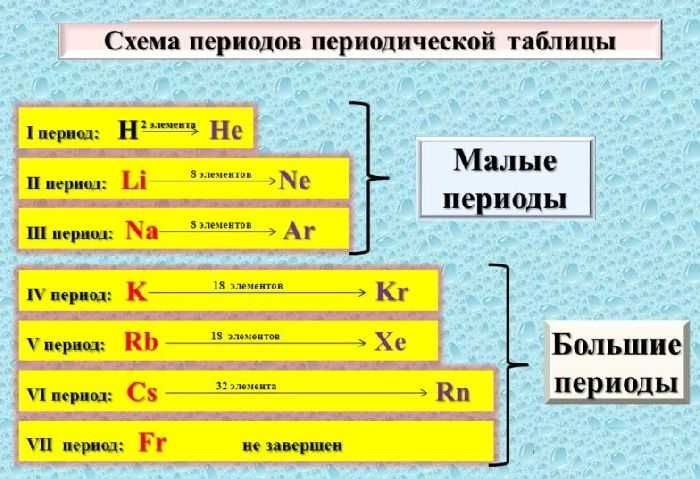 Рис. 3. Малые и большие периоды в таблице Менделеева.
Рис. 3. Малые и большие периоды в таблице Менделеева.
Периодически также повторяются такие свойства атомов, как энергия ионизации, энергия сродства к электрону и электроотрицательность. Эти величины связаны со способностью атома отдать электрон с внешнего уровня (ионизация) или удержать чужой электрон на своем внешнем уровне (сродство к электрону).
Что мы узнали?
Периодический закон и периодическая система химических элементов Д. И. Менделеева, изучаемые в 9 классе, дали толчок для развития всей мировой науки. таким образом, сущность периодичности изменения свойств элементов определяется строением их атомов и особенно повторением электронной конфигурации (строения) внешнего электронного уровня.
-
/10
Вопрос 1 из 10
Длиннопериодный вариант (современный).
Отличный современный вариант. К сожалению качество изображения слегка ужато. Видимо автор использует оригинальную версию где-то в коммерческих целях. Подойдёт для черно-белой печати на формате А4.
Включает 114 элементов, по каждому из них вы можете видеть название элемента на русском, английском и латинском, номер, атомная масса, температуры плавления и кипения, электроотрицательность по Полингу и Аллреду, распределение электронов по энергетическим уровням;
Размер изображения: 1796х1111;
Формат файла: JPG;
Размер — файла: 590 Кб.
Периодическая система от американского химика-коллекционера, автора книги «Сумасшедшая наука». Особенность данного издания заключается в том, что в каждой клетке элемента содержится изображение простого вещества, соответствующего ему, либо изделие из простого вещества данного элемента. В случае с трансурановыми короткоживущими элементами мы видим портрет учёного в честь которого он назван.
Включает 118 элементов с минимальной информацией: символ элемента, название, номер и внешний вид. Очень хорошо изображение подходит в качестве обоев на рабочий стол.
Размер изображения: 1173х605;
Формат файла: JPG;
Размер файла: 239 Кб.
Вариант периодической системы в стиле нашумевшего сериала Breaking Bad (Во все тяжкие). Выполнен дизайнером Ciaran Nash. Несмотря на такой, казалось бы, минималистический дизайн, данная таблица содержит все необходимые данные о каждом элементе: символ элемента, номер, относительная атомная масса, распределение электронов по уровням. Однако, при этом таблица не содержит названий элементов так что в качестве пособия для обучения не годится.
Изображение содержит 118 элементов, даже ливерморий и флеровий на ней обозначены, в отличие от других вариантов. Неплохо подойдёт тем, кто уже неплохо знает химию, а также в качестве красивых обоев на рабочий стол.
Размер изображения:2560х1309;
Формат файла: JPG;
Размер файла: 538 Кб.
Элементы таблицы Менделеева
Существует также класс «металлоподобных» полупроводников с неопределенным состоянием. Благородные газы, не вступающие в реакции, находятся отдельно.
Часть элементов с номерами больше 100 были обнаружены сравнительно недавно, их принадлежность к какой-либо группе является лишь предположением.
Щелочные и щелочноземельные элементы
Представители групп 1 (IA) и 2 (IIA) таблицы Менделеева — металлы с плохой стабильностью и высокой степенью растворимости.
Щелочные металлы имеют серебристый блеск и легко ломаются и режут. Из всех помещенных на столе металлов они активнее других реагируют с молекулами других веществ, отдавая единственный свободный электрон. При контакте с водой образуются гидроксиды – щелочи:
2Na + 2H2O = 2NaOH + H2
Щелочноземельные металлы более твердые и тугоплавкие, с бледно-серым оттенком.
Большинство из них способны создавать щелочь, но их не так легко отделить от двух незанятых электронов. Они заменяют другие металлы, но бессильны против щелочных металлов и вытесняются ими из молекул.
Галогены и благородные газы
Галогены и благородные газы сгруппированы в группы 17 и 18 периодической таблицы. Галогены — неметаллические элементы, все они имеют семь электронов на внешней оболочке. В благородных газах все электроны находятся на внешней оболочке, поэтому практически не участвуют в образовании соединений. Эти газы называются «благородными», потому что они редко реагируют с другими элементами; то есть относится к членам благородной касты, которые традиционно избегали других людей в обществе.
| Галогены | Благородные газы |
| Фтор F 9 | Гелий он 2 |
| Хлор Cl 17 | Неон Неон 10 |
| Бром Бр 35 | Аргон Ар 18 |
| Йод I 53 | Криптон Кр 36 |
| Астатин в 85 лет | Ксенон Хе 54 |
| — | Радоновый р-н 86 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды представляют собой группу элементов, изначально обнаруженных в редких минералах; отсюда и название «редкоземельные элементы». Впоследствии оказалось, что эти элементы не так редки, как считалось сначала, и поэтому редкоземельным элементам было дано название лантаноиды. Лантаниды и актиноиды занимают два блока, которые расположены ниже основной таблицы элементов. Обе группы включают металлы; все лантаноиды (кроме прометия) не радиоактивны; актиниды, с другой стороны, радиоактивны.
| Лантаноиды | Актиниды |
| Лантан Ла 57 | Актиний Ac 89 |
| Церий Се 58 | Торий Th 90 |
| Празеодим Пр 59 | Протактиний Па 91 |
| Неодим Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий См 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Ам 95 |
| Гадолиний Бог 64 | Кюриум см 96 |
| Тербий Тб 65 | Берклиум Бк 97 |
| Диспрозий Dy 66 | Калифорния cf 98 |
| Гольмий Хо 67 | Эйнштейний 99 |
| Эрбий Er 68 | Ферми FM 100 |
| Тулий Тм 69 | Менделевий Мд 101 |
| Иттербий Yb 70 | Нобелий № 102 |
Неметаллы
Из всех элементов, отнесенных к неметаллам, водород принадлежит к первой группе таблицы Менделеева, а остальные к группам 13-18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно они находятся в газообразном (водород или кислород) или твердом (углерод) состоянии при комнатной температуре).
| Нет металлов |
| Водород H1 |
| C6 углерод |
| Азот №7 |
| Кислород О8 |
| Фосфор Р 15 |
| Сера S16 |
| Селен Se 34 |
| Флеровиум Фл 114 |
| Унунсептиус Уус 117 |
Металлоиды
Металлоиды занимают 13-16 группы периодической таблицы. Металлоиды, такие как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных микросхем и печатных плат.
| Металлоиды |
| Бор B5 |
| Кремний Да 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Те 52 |
| Полоний Ро 84 |
Переходные металлы
Переходные металлы занимают группы 3-12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (через которые они соединяются с другими элементами) находятся в нескольких электронных оболочках.
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ти 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец марганец 25 |
| Железо Fe 26 |
| Кобальт Co27 |
| Никель Ni 28 |
| Медь Cu29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr40 |
| Ниобий Nb 41 |
| Молибден Мо 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Лу 71 |
| Гафний Hf 72 |
| Тантал Та 73 |
| Вольфрам W74 |
| Рений Ре 75 |
| Осмий Ос 76 |
| Иридий Ир 77 |
| Платина, часть 78 |
| Au 79 Золото |
| Меркурий ртутного столба 80 |
| Лоуренсио Lr 103 |
| Резерфордий Rf 104 |
| Дубний Дб 105 |
| Сиборгиум Sg 106 |
| Бори Бх 107 |
| Хассиум Hs 108 |
| Мейтнериум гора 109 |
| Дармштадт Дс 110 |
| Рентген Рг 111 |
| Коперник Cn 112 |
Постпереходные металлы
Они тоже «легкие». Отличаются от переходных аналогов меньшей твердостью и весом. У них разные температуры плавления и кипения. Для соединений электроны отдаются только с внешней оболочки. По степени восстановления они превосходят полуметаллы. Легкий металл выглядит как вещество с матовым покрытием, а не блестящим.
Строение атома
Великие ученые и философы древности упорно бились над вопросом, из чего же состоят вещества, которые их окружают. Впервые идею о том, что все тела живой и неживой природы состоят из мельчайших частиц — атомов — высказал древнегреческий ученый Демокрит целых 2500 лет назад!
Что же из себя представляет атом?
Атом — это мельчайшая химически неделимая частица вещества.
Атомы могут соединяться друг с другом с помощью химических связей в различной последовательности, образуя более сложные частицы — молекулы. Можно провести аналогию:
- атом — отдельный человек,
- молекулы — группы людей, объединенные общим признаком (семья, одноклассники, коллеги, любители кошек, любители собак).
Молекула — это мельчайшие частицы, которые состоят из атомов. Они являются химически делимыми.
Долгое время считалось, что атом нельзя разделить далее на составляющие. Но с развитием науки учёные-физики выяснили, что атом состоит из более мелких, или элементарных частиц — протонов (p), нейтронов (n) и электронов (ē).
В центре атома располагается ядро, которое состоит из протонов и нейтронов (их общее название нуклоны), а вокруг ядра вращаются электроны.
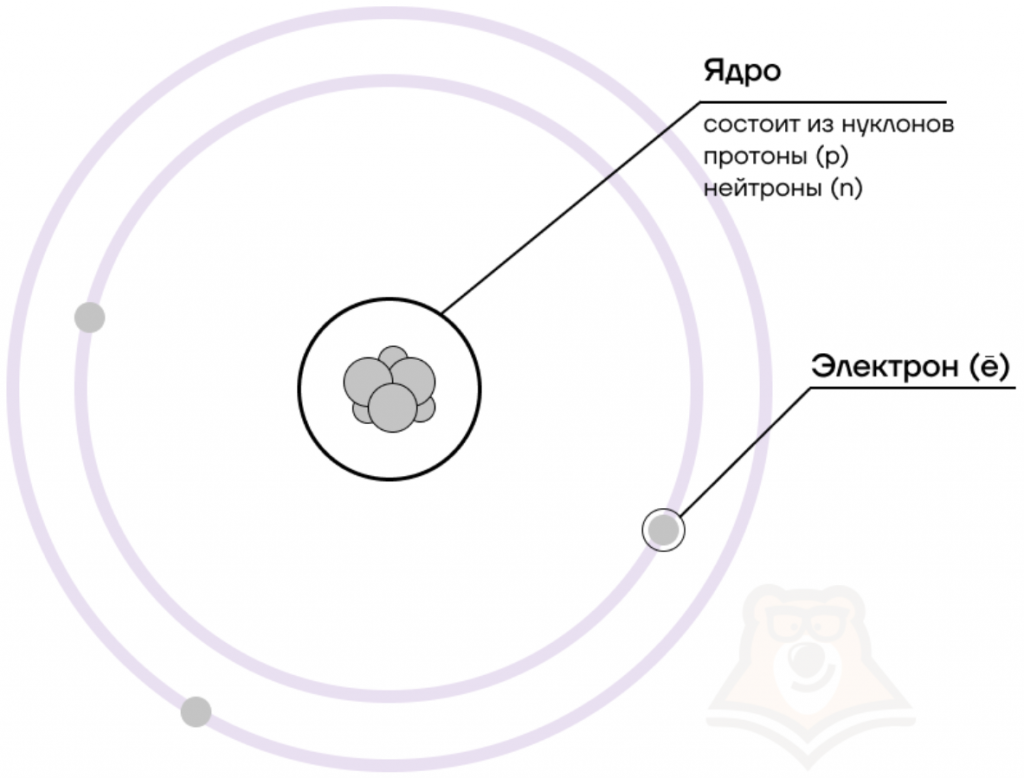
| Чем атом похож на Солнечную систему?Можно представить атом как Солнечную систему, где вокруг ядра (Солнца) по орбитам вращаются электроны (планеты). Это так называемая планетарная модель атома. В реальности атом намного сложнее, но для запоминания нам удобнее пользоваться этими представлениями. |

Тогда более точно определение атома будет звучать так:
Атом — электронейтральная химически неделимая частица, которая состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов.
Каждая из элементарных частиц в атоме имеет свой заряд и массу:

Характеристика металлов IIIA группы
Представители —В, Al, Ga, In, Tl. Бор в этой подгруппе — единственный неметалл. Заряд ядер атомов возрастает от 5 у бора до 81 у таллия. Атомный радиус в том же порядке увеличивается с 0,091 до 0,171 нм. Электроотрицательность снижается с 2,04 до 1,44.
Для электронной конфигурации металлов IIIA группы характерно наличие двух спаренных s-электронов и одного р-электрона. В «реальном» атоме все электроны внешнего энергетического уровня выравниваются по форме и энергии в результате sp2-гибридизации. Характерные валентность, степень окисления и заряд ионов в этой группе — III(+), +3, 3+ соответственно. Изменения свойств представлены в схеме 1.
Схема 1. Характеристика IIIA группы
Простые вещества имеют металлический блеск, серебристо-белый цвет. Они относительно легкоплавкие и мягкие. Лист или проволока из алюминия легко сгибаются, а индий — один из самых мягких металлов. Талий не только мягкий, но и твердеет при низкой температуре около –60°С.
Эка-таллий или нихоний — относительно недавно открытый, еще недостаточно изученный элемент IIIA группы.
Свойства галлия и индия близки к химии алюминия. Причина — одинаковое строение внешнего энергетического уровня. Алюминий имеет высокие тепло- и электропроводность.
Общие свойства металлов IА–IIIА групп ПС обусловлены сходством в электронном строении внешних электронных оболочек. Радиусы атомов и свойства закономерно изменяются. Более сильные металлические элементы — последние представители в группах. Самые сильные металлы относятся к IА группе. К IIIА группе металлические свойства ослабевают.
Смотри также:
- Закономерности изменения свойств элементов и их соединений по периодам и группам
- Характеристика переходных элементов (меди, цинка, хрома, железа)
- Общая характеристика неметаллов IVА–VIIА групп
Как таблицу Менделеева пополнили ядерные элементы
 Здесь создают новые химические элементы
Здесь создают новые химические элементы
Вряд ли Менделеев предполагал, как далеко зайдут его последователи в поиске продолжения таблицы: в его время элементы получали только из природных материалов — минералов, руд.
Открытие ядерной реакции позволило создать новый способ «пополнения» таблицы: расщепление урана (элемент 92) позволило создать трансурановые элементы, вместе с которыми известно 118 элементов.
Все они не существуют в природе в достаточном для поиска количестве, либо имеют слишком короткий срок жизни. Для их получения ученые сталкивают атомы разных элементов (сегодня используют комбинацию «пучок атомов»->«мишень») , что приводит к их слиянию.
 Юрий Оганесян из НИЯУ МИФИ, соавтор открытия 5 трансурановых элементов
Юрий Оганесян из НИЯУ МИФИ, соавтор открытия 5 трансурановых элементов
Например, для создания теннесина (номер 117 соответствует числу протонов в ядре) ученые объединили пучки кальция (20 протонов) с мишенью из беркелия (97 протонов).
Синтез кальция с калифорнием (98) позволил появиться на свет долгоживущему изотопу оганесона (118).
Химические элементы, встречающиеся в природе
В природе встречаются элементы с атомными номерами от 1 (водород) до 98 (калифорний).
Десять из этих элементов можно найти, хотя и кратко, в природе в очень незначительных количествах: технеций (число 43), прометий (число 61), астат (число 85), франций (число 87), нептуний (число 93), плутоний (номер 94), америций, кюрий (номер 96), берклий (номер 97) и калифорний (номер 98).
Редкие элементы образуются в результате радиоактивного распада и других ядерных процессов более общих элементов. Например, франций содержится в настуране в результате альфа-распада актиния.
Некоторые элементы, обнаруженные сегодня, могли образоваться в результате распада первичных элементов, то есть элементов, образовавшихся ранее в истории Вселенной, которые с тех пор исчезли.
Вот список природных элементов с соответствующими символами. Цвета относятся к месту их нахождения в периодической таблице:
Элементы обнаруживаются в звездах, туманностях и сверхновых по их спектрам. Хотя на Земле встречаются практически те же элементы, что и во вселенной, пропорции элементов и их изотопов отличаются.
Как таблицу Менделеева проверили и доделали другие
 Мозли связал номер элемента в Таблице и его физические свойства
Мозли связал номер элемента в Таблице и его физические свойства
Окончательный вид подтверждения Периодического закона нашел английский физик Генри Мозли:
Закон Мозли — закон, связывающий частоту спектральных линий характеристического рентгеновского излучения атома химического элемента с его порядковым номером.
Это привело к более глубокой трактовке закона, о котором Менделеев не мог даже догадываться:
️ порядковый номер элемента = мера электрического заряда атомного ядра этого элемента,
️ номер горизонтального ряда (периода) = число электронных оболочек атома,
️ номер вертикального ряда (группы) определяет квантовую структуру оболочки, что определяет сходство химических свойств.
Легенды и факты о происхождении таблицы Менделеева
Происхождение знаменитой периодической таблицы окутано множеством мифов. Одним из наиболее распространенных является заблуждение, что идея системы пришла к ученому во сне. В действительности сам химик опроверг данную легенду и утверждал, что он на протяжении долгих лет трудился над ее разработкой. Для систематизации элементов он записывал их все на отдельные карточки и множество раз пытался их сочетать, располагая карточки в ряд, исходя из похожих свойств.
Легенда о вещем сне появилась из-за того, что сам ученый трудился над классификацией всех химических веществ сутками, изредка делая перерыв на пару часов сна. Но только многолетняя упорная работа и прирожденный талант Менделеева дали результат в виде всем известной таблицы и принесли перспективному ученому известность на весь мир.
Круговорот биофильных частиц: углерод
Каждый атом способен совершать переход из организма в окружающую среду и обратно. При этом происходит процесс, получивший название «круговорот биогенных элементов». Рассмотрим его сущность на примере атома углерода.
Атомы проходят несколько этапов в своем круговороте.
- Основная масса находится в недрах земли в виде каменного угля, а также в воздухе, формируя слой углекислого газа.
- Из воздуха углерод переходит в растения, так как поглощается ими для фотосинтеза.
- Затем либо остается в растениях до их отмирания и переходит в залежи каменного угля, либо переходит в животные организмы, которые питаются растениями. Из них углерод возвращается в атмосферу в виде углекислого газа.
- Если же говорить о том углекислом газе, что растворен в Мировом океане, то из воды он попадает в ткани растений, со временем формируя известняковые залежи, либо испаряется в атмосферу и снова начинается прежний круговорот.
Таким образом происходит биогенная миграция химических элементов, как макро-, так и микробиогенных.
Значение
Периодическая система Д. И. Менделеева стала важнейшей вехой в развитии атомно-молекулярного учения. Благодаря ей было предсказано существование неизвестных науке химических элементов, установлено их положение относительно известных в таблице и их свойства. Позже многие элементы были обнаружены и встали на те места, которые предсказал Менделеев в своей таблице.
Благодаря ей сложилось современное понятие о химическом элементе, были уточнены представления о простых веществах и соединениях.
Прогнозирующая роль периодической системы, показанная ещё самим Менделеевым, в XX веке проявилась в оценке химических свойств трансурановых элементов.
Появление периодической системы и открытие периодического закона открыло новую, подлинно научную эру в истории химии и ряде смежных наук — взамен разрозненных сведений об элементах и соединениях. Д. И. Менделеевым и его последователями создана стройная система, на основе которой стало возможным обобщать, делать выводы, предвидеть.