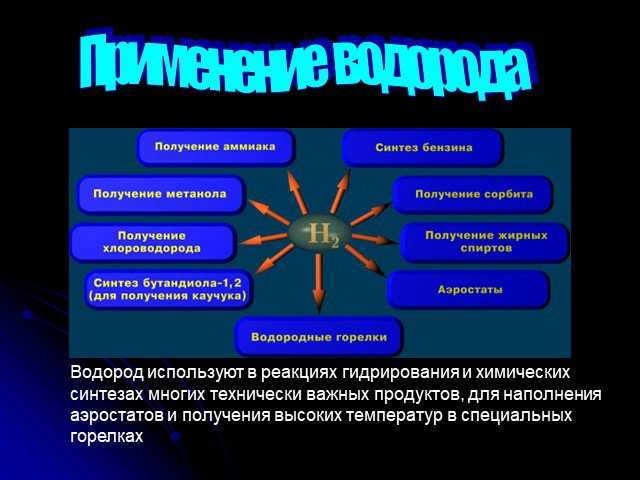
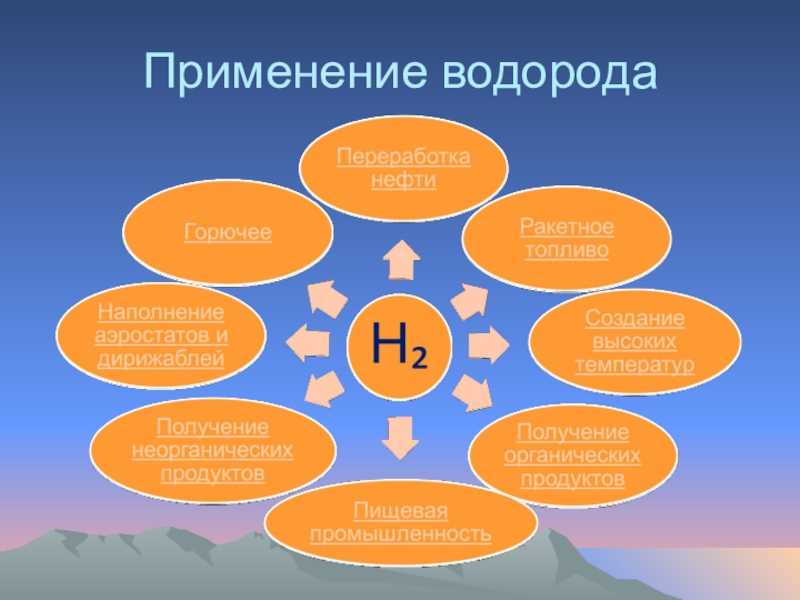
Слайд 17Зорина Наталья Николаевна, учитель биологии и экологииПеречислите биоэлементы и объясните, каково
их значение в образовании живой материи
К биоэлементам (органогенам) относят кислород, углерод, водород, азот, фосфор и серу. Они составляют основу белков, липидов, углеводов, нуклеиновых кислот и других органических веществ. Для всех органических молекул особое значение имеют атомы углерода, образующие каркас. К этому каркасу присоединяются разнообразные химические группы, образованные другими биоэлементами. В зависимости от состава и расположения таких групп органические молекулы приобретают индивидуальные свойства и функции. Например, аминокислоты в большом количестве содержат азот, а нуклеиновые кислоты — фосфор

Физические свойства металлов
Металлы при нормальных условиях — твердые вещества (кроме франция и ртути). Металлы в кристаллическом состоянии хорошо отражают световые лучи и поэтому им характерен металлический блеск. Индий и серебро благодаря хорошему светоотражению используются при изготовлении прожекторов и рефлекторов. Все металлы, кроме алюминия и магния, в измельченном состоянии (порошкообразном) имеют темный и темно-серый цвет. Кроме золота и меди, все остальные металлы имеют белый или серый цвет.
Все металлы хорошо проводят электрический ток и тепло. Медь и серебро в этом отношении стоят на первом месте.
Металлы ковкие и пластичные. Пластичность — это свойства вещества изменять форму под воздействием внешних сил . Самым пластичным металлом считается золото. Оно раскатывается и в тонкую фольгу и вытягивается в тонкую нить.
Металлическая связь
Характерные свойства металлов объясняются особенностями их внутреннего строения. Узлы кристаллической решетки металлов заняты нейтрально заряженными атомами, положительно заряженными ионами, а в промежутке имеются свободные электроны, находящиеся в постоянном движении. В металлах постоянно происходит отделение электронов от атомов и присоединение их к ионам. Наличием этих свободных электронов и обусловливается хорошая электро- и теплопроводность металлов. Эти электроны считаются общими для всего кристалла.
Химическая связь, возникающая между положительными ионами и общими электронами в металле, называется металлической связью.
Металлическая связь характерна только для металлов, независимо от того, в твердом или в жидком состоянии они находятся.
Плотность, температура плавления и кипения, твердость являются особенностью атома и зависят от заряда ядра, массы и прочности металлической связи.
По общей плотности металлы делятся на легкие, плотность которых меньше 5000 кг/м3 (литий, натрий, магний, алюминий и др.), и тяжелые, плотность которых выше 5000 кг/м3 (цинк, железо, медь, ртуть, платина, золото, осмий и др.).
Если самая низкая температура плавления присуща ртути (-38,87°C), то самая высокая характерна вольфраму (3410°C). Если самые твердые металлы — хром и вольфрам, то самые мягкие — натрий, калий и индий.
Hydrogen – топливо будущего
Истощение углеводородных видов топлива, а также их негативное влияние на окружающую среду являются одними из главных причин для поиска альтернативного источника энергии. Водород имеет все необходимые характеристики, чтобы заменить имеющиеся виды топлива. Однако, существует несколько сдерживающих факторов для технологического прорыва.
Первые водородные двигатели были изобретены еще в XIX веке. Сегодня множество крупных автомобильных компаний работают над совершенствованием транспорта, работающего на этом топливе. К ним относятся BMW, Audi, Ford, Nissan, Toyota, Honda и пр. В ограниченной серии уже выпущены легковые автомобили BMW Hydrogen 7, Mazda RX-8 Hydrogen RE, Audi A7 h-tron quattro. Перевозкой пассажиров занимаются автобусы Ford E-450 и Mercedes-Benz Citaro, поезд Coradia iLint компании Alstom. Корпорация Boeing Company также работает над созданием самолета с использованием водородных топливных элементов.

Тем не менее, в работе с данным химическим веществом, есть и свои минусы:
- снижение мощности двигателя до 80-60% в сравнении с бензиновым аналогом;
- летучесть вещества;
- возможность его взаимодействия с корпусом автомобиля, что значительно увеличивает износ материалов;
- трудности в хранении и транспортировке топлива;
- сложности при обеспечении безопасного использования (вещество легко воспламеняется).
Тем не менее, эти преграды не останавливают прогресс. С каждым годом двигатели и топливные элементы становятся более совершенными. Поэтому можно ожидать, что в недалеком будущем Hydrogen составит серьезную конкуренцию нефти.
Неумывакин
Водород как химический элемент настолько хорош, что у него не могли не появиться собственные фанаты. Иван Павлович Неумывакин — доктор медицинских наук, профессор, лауреат Государственной премии и ещё много у него званий и наград, — в их числе. Будучи врачом традиционной медицины, он назван лучшим народным целителем России. Именно он разрабатывал многие методы и принципы оказания медицинской помощи космонавтам, находящимся в полёте. Именно он создал уникальный стационар — больницу на борту космического судна. В то же самое время был государственным координатором направления косметической медицины. Космос и косметика. Его увлечение водородом направлено не на то, чтобы сделать большие деньги, как это сейчас бытует в отечественной медицине, а напротив — научить народ вылечиваться от чего угодно буквально копеечным средством, без дополнительного посещения аптек.
Он пропагандирует лечение препаратом, который присутствует буквально в каждом доме. Это — перекись водорода. Неумывакина можно сколько угодно критиковать, он всё равно будет настаивать на своём: да, действительно, перекисью водорода можно вылечить буквально всё, потому что она насыщает внутренние клетки организма кислородом, разрушает токсины, нормализует кислотное и щелочное равновесие, а отсюда регенерируются ткани, омолаживается весь организм. Вылечившихся перекисью водорода пока ещё никто не видел и тем более не обследовал, однако Неумывакин утверждает, что, пользуясь этим средством, можно полностью избавиться от вирусных, бактериальных и грибковых заболеваний, предупредить развитие опухолей и атеросклероза, победить депрессию, омолодить организм и никогда не болеть ОРВИ и простудой.
В зависимости от внешних условий Н может быть жидким, твердым или газообразным
Интересный факт про водород – он может находиться в нескольких агрегатных состояниях. В обычных условиях, при средних температурах окружающей среды он наиболее часто встречается в виде газа – Н2. Температур плавления химического элемента составляет -259,14 С. В этом случае он переходит в жидкое состояние, что очень удобно для его транспортировки (поскольку газ занимает больше места). Также, жидкий Н используют в качестве составляющей для ракетного топлива.

Находясь под воздействием высокого давления, Hydrogen переходит в твердое состояние – металлический водород. Считается, что подобное вещество входит в состав планет «газовых гигантов». Однако, это утверждение пока остается только гипотезой.
Первая водородная бомба
К XX веку человечество осознало, что Hydrogen можно использовать не только в мирных целях. Во время гонки вооружений в период холодно войны советские и американские ученые стремились превзойти друг друга в военной промышленности. Они создавали оружие со значительной поражающей мощностью на основании водородного изотопа дейтерия. Термоядерная реакция возникает во время синтеза легких газов в тяжелые: во время этого процесса высвобождается огромное количество энергии. Первые испытания термоядерного заряда проводились в США 1 ноября 1952 года. По сути, устройство не являлось бомбой, а представляло лабораторный прототип. Спустя год, 12 августа 1953, в СССР продемонстрировали уже полностью готовую к эксплуатации водородную бомбу РДС-6с.

Водородная бомба

Взрыв водородной бомбы
Этот вид оружия имел огромную разрушительную силу. Мощность его взрыва превышала возможности ядерного оружия. При этом считалось, что количество ядерных осадков от него значительно меньше. В процессе дальнейших исследований было выяснено, что все зависит от типа выбранной реакции. Если в изделие включается термоядерный заряд с использованием урана-238 (радиоактивный нуклид урана), то мощность бомбы возрастет в пять раз, в количество радиоактивных осадков увеличится в 10 раз.
1.3. Концентрация и рассеянность элементов в земной коре
Вы уже знаете, что одно из важнейших отличий геохимии от химии в том, что геохимия рассматривает только те химические взаимодействия, которые реализуются в конкретных природных условиях. И учёт кларков (по крайней мере их порядков) в этом смысле является первоочередным требованием при любых геохимических построениях.
В то же время вы сами, безусловно, уже обратили внимание, что существуют, и даже достаточно распространены самостоятельные минеральные фазы целого ряда элементов с низкими кларками. Причина в том, что в природе существуют механизмы, позволяющие обеспечивать формирование повышенных концентраций тех или иных элементов, в результате чего их содержание в каких-то участках могут многократно превышать кларковые
Поэтому кроме кларка элемента нужно учитывать и величину его концентрации в сравнении с кларковым содержанием.
Для этого введено понятие «кларк концентрации» (или «коэффициент концентрации»). Последний термин более корректен, так как понятие кларка введено именно для средних содержаний, и лучше для характеристики содержаний повышенных такой же термин не использовать. Но всё же в литературе вы часто можете встретить именно термин «кларк концентрации».
КК – это соотношение содержания химического элемента в данном конкретном природном вещественном агрегате (горной породе и т.п.) к его кларку.
Примеры коэффициентов концентрации некоторых химических элементов в их рудных месторождениях:
Al – 3,7
Mn — 350
Cu — 140
Sn — 250
Zn — 500
Au – 2000
На этом основании элементы с низкими кларками подразделяются на две уже известные вам качественно различные группы. Те, для распределения которых не характерны высокие значениями КК, называются рассеянными (Rb, Ga, Re, Cd и др.). Способные формировать повышенные концентрации с высокими значениями КК – редкими (Sn, Be и др.).
Различиями в достигаемых величинах КК обусловлена разная роль тех или иных элементов в истории материально-технической деятельности человечества (с древности известные металлы с низкими кларками Au, Cu, Sn, Pb, Hg, Ag … — и более распространённые Al, Zr…).
Строение и физические свойства
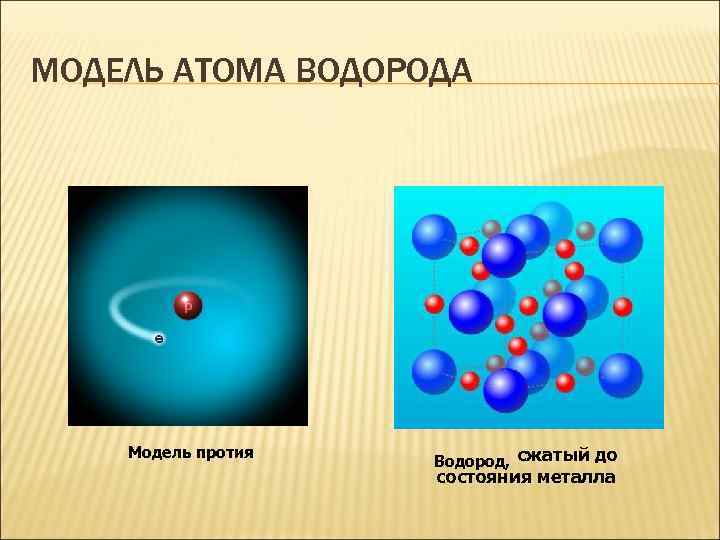
По строению атом водород наиболее прост по сравнению со всеми другими элементами: одно ядро — один электрон. Потенциал ионизации — энергия связи ядра с электроном — 13,595 электронвольт (eV). Именно из-за простоты этого строения атом водорода удобен как модель в квантовой механике, когда нужно рассчитать энергетические уровни более сложных атомов. В молекуле Н2 — два атома, которые соединены химической ковалентной связью. Энергия распада очень велика. Атомарный водород может образоваться в химических реакциях, например цинка и соляной кислоты. Однако взаимодействие с водородом практически не происходит — атомарное состояние водорода очень коротко, атомы сразу рекомбинируют в молекулы Н2.
С физической точки зрения водород легче всех известных веществ — более чем в четырнадцать раз легче воздуха (вспомним улетающие воздушные шарики на праздниках — внутри у них как раз водород). Однако он умеет кипеть, сжижаться, плавиться, затвердевать, и только гелий кипит и плавится при более низких температурах. Сжижать его сложно, нужна температура ниже -240 градусов по Цельсию. Зато теплопроводность он имеет очень высокую. В воде почти не растворяется, зато прекрасно происходит взаимодействие с водородом металлов — он растворяется почти во всех, лучше всего в палладии (на один его объем водорода уходит восемьсот пятьдесят объемов). Жидкий водород лёгок и текуч, а когда растворяется в металлах, часто разрушает сплавы из-за взаимодействия с углеродом (сталь, например), происходит диффузия, декарбонизация.
Определение водорода
Водород — самый распространенный во Вселенной элемент. Он составляет основную часть массы Солнца и других звезд. Водород входит в состав газообразных туманностей, межзвездного газа, звезд во Вселенной, где его атомы превращаются в атомы гелия. Этот процесс происходит с выделением энергии (термоядерная реакция), что служит для многих звезд, в том числе и Солнца, основным источником энергии.

Рис.23 Полет воздушного шара, заполненного водородом. Париж, 1783 г.

Эта энергия необходима для многих природных процессов. Солнечная энергия согревает Землю, приводит в движение воздушные массы атмосферы и воду рек, морей и океанов, обеспечивает процесс фотосинтеза у зеленых растений, наконец, является основным условием для существования жизни.
Водород широко распространен на Земле в виде свободной воды, кристаллизационной воды минералов, метана и углеводородов нефти, различных гидроксидов, растительной и животной биомассы, органического вещества почвы.
Водород и кислоты
Среди соединений водорода, встречающихся в природе, особое место занимают кислоты (кислые воды).
Вспомните услаждающий вкус газированной воды и других прохладительных напитков или сок урюка и кислый вкус ревеня в жаркий летний день. Наверное, каждый знает кисловатый вкус лимона. В природе встречается очень много кислот.
В плодах цитрусовых (лимон, апельсин, мандарин) содержится лимонная кислота, в свежих фруктах (яблоки, айва, фанат) — яблочная кислота, в листьях щавеля и подорожника — щавелевая кислота, в брюшке у муравьев (а также в яде пчел) — муравьиная кислота, в газированной воде содержится угольная кислота.
Многие для приготовления пищи, а особенно печеного, используют уксусную кислоту, которая также применяется для приготовления консервов из овощей. Известно, что уксусную кислоту можно получить брожением винограда или яблок. Если вы будете наблюдать за прокисанием молока, то узнаете, что причиной этого является молочная кислота. В сельской местности готовят силос, в результате чего образуются молочная, масляная и другие кислоты. Для всех вышеназванных кислот характерен кислый вкус, и все они являются соединениями водорода.
Такие вещества, как лакмус, метилоранж, универсальный индикатор, по-разному окрашиваются в растворах кислот: лакмус краснеет, метилоранж становится розовым, универсальный индикатор приобретает красную окраску (рис. 26).
При взаимодействии металлов (магний, цинк, железо, медь) с растворами кислот (неорганических кислот, полученных синтетическим путем) реакция протекает по-разному, в частности, магний вытесняет водород из кислоты быстрее, цинк и железо — медленнее, а медь вообще не вытесняет.
Значит, кислоты — это вещества, которые обладают следующими общими свойствами:
- растворы кислот обладают кислым вкусом (в этом можно убедиться на примере природных кислот; пробовать на вкус синтетические кислоты опасно для жизни);
- растворы кислот изменяют окраску индикаторов;
- водные растворы почти всех кислот, взаимодействуя с целым рядом химически активных металлов, теряют водород.
Помимо натуральных есть еще синтетические кислоты, производимые химической промышленностью, которые также являются водородными соединениями. Всем известно, что при желудочно-кишечных расстройствах по указанию врача необходимо принимать слабый раствор соляной кислоты, или то, что серная кислота применяется в аккумуляторных батареях автомобилей.
Кислоты — это сложные вещества, которые обладают некоторыми общими свойствами.
Вещества, меняющие свою окраску в зависимости от специфических свойств соединений, называются индикаторами.

Рис. 26. Влияние растворов кислот на индикаторы
Химические свойства
В соединениях по большей части водород показывает степень окисления (валентность) +1, как натрий и другие щелочные металлы. Его и рассматривают как их аналог, стоящий во главе первой группы системы Менделеева. Но ион водорода в гидридах металлов заряжен отрицательно, со степенью окисления -1. Также этот элемент близок к галогенам, которые даже способны замещать его в органических соединениях. Значит, водород можно отнести и к седьмой группе системы Менделеева. В обычных условиях молекулы водорода активностью не отличаются, соединяясь только с самыми активными неметаллами: хорошо с фтором, а если светло — с хлором. Но при нагревании водород становится другим — он со многими элементами вступает в реакцию. Атомарный водород по сравнению с молекулярным очень активен химически, так в связи с кислородом образуется вода, а попутно выделяется энергия и тепло. При комнатной температуре эта реакция очень медленная, зато при нагревании выше пятисот пятидесяти градусов получается взрыв.
Используется водород для восстановления металлов, потому что у их оксидов он отнимает кислород. Со фтором водород образует взрыв даже в темноте и при минус двухсот пятидесяти двух градусах по Цельсию. Хлор и бром возбуждают водород только при нагревании или освещении, а йод — только при нагревании. Водород с азотом образует аммиак (так производятся большинство удобрений). При нагревании он очень активно взаимодействует с серой, и получается сероводород. С теллуром и селеном вызвать реакцию водорода трудно, а с чистым углеродом реакция происходит при очень высоких температурах, и получается метан. С оксидом углерода водород образует разные органические соединения, здесь влияют давление, температура, катализаторы, и всё это имеет огромное практическое значение. И вообще, роль водорода, а также и его соединений исключительно велика, поскольку он даёт кислотные свойства протонным кислотам. Со многими элементами образуется водородная связь, влияющая на свойства и неорганических и органических соединений.

Основные сведения
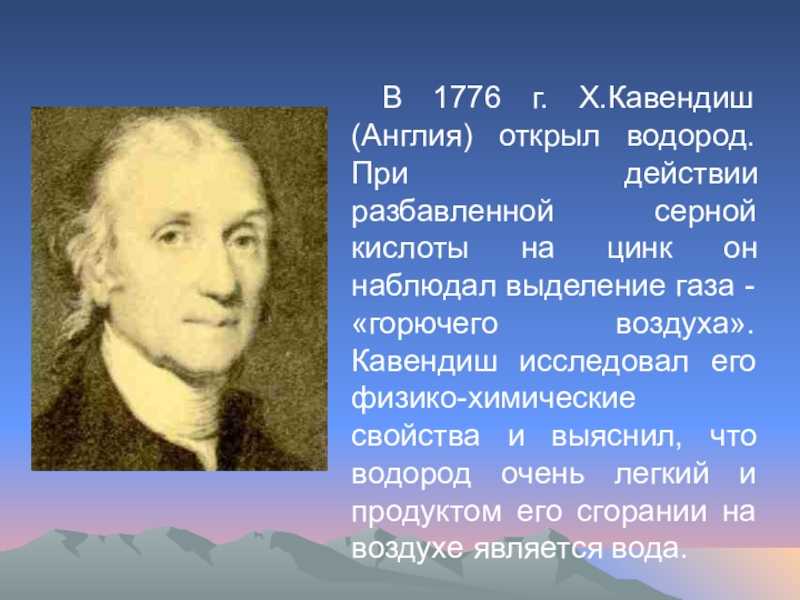
Hydrogenium (лат.) — водород, первый порядковый номер в таблице Менделеева, обозначается Н. Атом водорода имеет массу 1,0079, это газ, не имеющий при обычных условиях ни вкуса, ни запаха, ни цвета. Химики с шестнадцатого века описывали некий горючий газ, обозначая его по-разному. Но получался он у всех при одинаковых условиях — когда на металл воздействует кислота. Водород даже самим Кавендишем много лет назывался просто «горючий воздух». Лишь в 1783 году Лавуазье доказал, что вода имеет сложный состав, путём синтеза и анализа, а через четыре года он же и дал «горючему воздуху» его современное название. Корень этого сложного слова широко употребляется, когда нужно называть соединения водорода и какие-либо процессы, в которых он участвует. Например, гидрогенизация, гидрид и тому подобное. А русское название предложил в 1824 году М. Соловьёв.
В природе распространение этого элемента не имеет равных. В литосфере и гидросфере земной коры его масса — один процент, зато атомов водорода — целых шестнадцать процентов. Наиболее распространена на Земле вода, и 11,19% по массе в ней — водород. Также он непременно присутствует практически во всех соединениях, из которых состоят нефть, уголь, все природные газы, глина. Есть водород и во всех организмах растений и животных — в составе белков, жиров, нуклеиновых кислот, углеводов и так далее. Свободное состояние для водорода не характерно и почти не встречается — его очень немного в природных и вулканических газах. Совсем ничтожный объем водорода в атмосфере — 0,0001%, по количеству атомов. Зато целые потоки протонов представляют водород в околоземном пространстве, из него состоит внутренний радиационный пояс нашей планеты.

Наружно
Компрессы и полоскания ещё до создания профессором Неумывакиным его методики были весьма популярны. Все знают, что так же, как и спиртовые компрессы, в чистом виде перекись водорода применять нельзя, потому что получится ожог тканей, а вот бородавки или грибковые поражения смазывают локально и крепким раствором — до пятнадцати процентов.
При кожных высыпаниях, при головных болях тоже делают процедуры, в которых участвует перекись водорода. Компресс нужно делать с помощью хлопковой ткани, смоченной в растворе из двух чайных ложек трёхпроцентной перекиси водорода и пятидесяти миллиграммов чистой воды. Ткань накрыть плёнкой и укутать шерстью или полотенцем. Время действия компресса от четверти часа до полутора часов утром и вечером до выздоровления.
Как мы его используем
Обнаружил водород в 1766 году Генри Кавендиш, когда анализировал реакцию окисления металла. Через несколько лет наблюдений он понял, что в процессе горения водорода происходит образование воды. Ранее учёные выделяли этот элемент, но самостоятельным его не считали. В 1783 году водород получил имя гидроген (в переводе с греческого «гидро» — вода, а «ген» — рождать). Элемент, порождающий воду, — водород. Это газ, молекулярная формула которого Н2. Если температура близка к комнатной, а давление нормальное, этот элемент неощутим. Водород можно даже не уловить человеческими органами чувств — он безвкусен, не имеет цвета, лишён запаха. А вот под давлением и при температуре -252,87 С (очень большой холод!) этот газ разжижается. Так его и хранят, поскольку в виде газа он занимает гораздо больше места. Именно жидкий водород используют как ракетное топливо.
Водород может становиться твёрдым, металлическим, но для этого давление необходимо сверхвысокое, именно этим сейчас и занимаются самые видные учёные — физики и химики. Уже сейчас этот элемент служит альтернативным топливом для транспорта. Применение его похоже на то, как работает двигатель внутреннего сгорания: когда сжигают водород, высвобождается много его химической энергии. Также практически разработан способ создания топливного элемента на его основе: при соединении с кислородом происходит реакция, а посредством этого образуются вода и электричество. Возможно, скоро транспорт «пересядет» вместо бензина на водород — масса автомобилестроителей интересуется созданием альтернативных горючих материалов, есть и успехи. Но чисто водородный двигатель пока в перспективе, здесь множество трудностей. Однако и преимущества таковы, что создание топливного бака с твёрдым водородом идёт полным ходом, и учёные и инженеры отступать не собираются.

Слайд 18Зорина Наталья Николаевна, учитель биологии и экологииЧто такое микроэлементы? Приведите примеры
и охарактеризуйте биологическое значение этих элементов
Многие химические элементы содержатся в живых системах в очень малых количествах (доли процента от общей массы). Такие вещества называют микроэлементами. В их числе медь, марганец, цинк, молибден, кобальт, иод, бром, фтор и многие другие. Растения, грибы, бактерии получают микроэлементы из почвы и воды; животные — в основном с пищей. В большинстве своем микроэлементы входят в состав белков и биологически активных веществ (гормонов, витаминов). Например, цинк содержится в гормоне поджелудочной железы инсулине, а иод — в тироксине (гормоне щитовидной железы). Кобальт является важнейшей составной частью витамина В12. Железо входит в состав примерно семидесяти белков организма, медь — в состав двадцати белков и т. д.

Перекись водорода (Н2О2)
Перекись водорода обладает хорошими очищающими и антисептическими свойствами. Раствор 3% Н2О2 широко используется в фармакологии и предназначен для наружного применения в результате нарушения целостности кожных покровов. Он является высокоэффективным средством для обработки некротизированных участков, размягчая ткани и вымывая гной и прочие патологические образования. В то же время, он затормаживает процесс заживления раны, поэтому должен использоваться в разумных мерах. Также, Н2О2 помогает растворить серные пробки в ушах.

Н2О2 является популярным удобрением для комнатных растений. Раствор оказывает положительное воздействие на поврежденные цветки, способствует избавлению от бактерий, ускоряет процесс цветения.
Водород использовали в качестве наполнителя для воздушных шаров
Поскольку Hydrogen имеет более легкий вес, чем воздух, его применяли для летательных аппаратов – дирижаблей и воздушных шаров. Однако, от этого вида наполнителя пришлось отказаться в связи с его высокой взрывоопасностью. Принято считать, что эра дирижаблей закончилась после катастрофы лайнера «Гинденбург» в 1937 году в Лейкхерсте. Тогда погибло 36 человек (35 на борту и один на земле).

При создании летательного аппарата «Гинденбург» немецкие конструкторы учитывали, что в нем мог использоваться гелий – более безопасный газ. Но, в те времена необходимыми запасами гелия владели США, где он был запрещен для экспорта. В результате «Гинденбург» был наполнен более дешевым водородом. Крушение дирижабля произошла во время посадки. Дирижабль воспламенился на глазах у публики, а весть о катастрофе быстро разлетелась по всему миру. Это окончательно погубило репутацию дирижаблей как безопасного вида транспорта.
Космос
В космосе ни один элемент не встречается так часто, как водород. Объем водорода в составе элементов Солнца — более половины его массы. Большинство звёзд образует водород, находящийся в виде плазмы. Основная часть разнообразных газов туманностей и межзвёздной среды тоже состояит из водорода. Он присутствует в кометах, в атмосфере целого ряда планет. Естественно, не в чистом виде, — то как свободный Н2, то как метан СН4, то как аммиак NH3, даже как вода Н2О. Очень часто встречаются радикалы СН, NH, SiN, OH, РН и тому подобные. Как поток протонов водород является частью корпускулярного солнечного излучения и космических лучей.
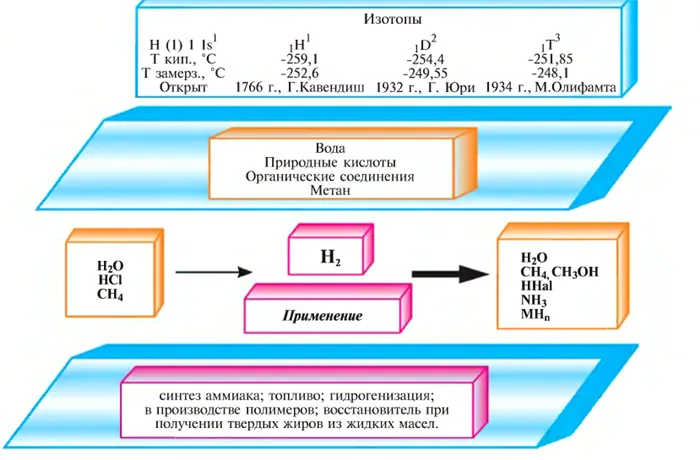
В обычном водороде смесь двух устойчивых изотопов — это лёгкий водород (или протий 1Н) и тяжёлый водород (или дейтерий — 2Н или D). Есть и другие изотопы: радиоактивный тритий — 3Н или Т, иначе — сверхтяжёлый водород. А ещё очень неустойчивый 4Н. В природе соединение водорода содержит изотопы в таких пропорциях: на один атом дейтерия приходится 6800 атомов протия. Тритий образуется в атмосфере из азота, на который воздействуют нейтроны космических лучей, но ничтожно мало. Что обозначают числа массы изотопов? Цифра указывает, что ядро протия — только с одним протоном, а у дейтерия в ядре атома не только протон, но и нейтрон. У трития в ядре к одному протону уже два нейтрона. А вот 4Н содержит три нейтрона на один протон. Поэтому физические свойства и химические у изотопов водорода очень сильно отличаются по сравнению с изотопами всех других элементов, — слишком большое различие масс.

Определение водорода
Водород — самый распространенный элемент во Вселенной. Она составляет большую часть массы Солнца и других звезд. Водород является компонентом космической газовой туманности, межзвездного газа и звезд, где его атомы превращаются в атомы гелия. В этом процессе происходит выделение энергии (термоядерные реакции), что является основным источником энергии для многих звезд, включая Солнце.

Рисунок 23: Полет воздушного шара, наполненного водородом. Париж, 1783 год.
Эта энергия необходима для многих природных процессов. Солнечная энергия согревает землю, приводит в движение газообразные массы атмосферы и воду в реках, океанах и морях, обеспечивает процесс фотосинтеза в зеленых растениях и, наконец, является фундаментальным условием для существования жизни.
Водород широко распространен на Земле в виде свободной воды, кристаллизационной воды минеральных вод, метана и нефтяных углеводородов, различных гидроксидов, растительной и животной биомассы и органического вещества почвы.
Водород и кислоты
Среди водородных соединений, встречающихся в природе, особое место занимают кислоты (кислые воды).
Вспомните освежающий вкус содовой и других безалкогольных напитков и абрикосового сока, или кислинку ревеня в жаркий летний день. Всем, наверное, знаком кислый вкус лимонов. В природе существует так много кислот, что неудивительно, что они часто встречаются в самых распространенных цитрусовых.
Цитрусовые (лимоны, апельсины, мандарины) содержат лимонную кислоту, свежие фрукты (яблоки, мармелад, колючие груши) содержат яблочную кислоту, листья свиязи и платана содержат щавелевую кислоту, муравьиные брюшки (и пчелиный яд) содержат муравьиную кислоту, а угольная кислота содержится в газированной воде.
Многие люди используют уксусную кислоту в кулинарии, особенно в приготовленных продуктах, также она используется в консервированных овощах. Известно, что уксусная кислота получается в результате ферментации винограда и яблок. Прокисание молока показывает, что причиной является молочная кислота. В сельской местности производят силос, из которого получают молочную, масляную и другие кислоты. Все вышеперечисленные кислоты характеризуются кислым вкусом и являются водородными соединениями.
Такие вещества, как камни, метилхлорид и универсальные маркеры, проявляют разные цвета в кислых растворах. Камни становятся красными, метилхлорид — розовым, а универсальный маркер — красным (рис. 26).
Когда металлы (магний, цинк, железо и медь) взаимодействуют с кислыми растворами (синтетическими неорганическими кислотами), реакции развиваются по-разному.
Таким образом, кислоты — это вещества со следующими общими характеристиками
- растворы кислот обладают кислым вкусом (в этом можно убедиться на примере природных кислот; пробовать на вкус синтетические кислоты опасно для жизни);
- растворы кислот изменяют окраску индикаторов;
- водные растворы почти всех кислот, взаимодействуя с целым рядом химически активных металлов, теряют водород.
Помимо природных кислот, существуют также синтетические кислоты, производимые химической промышленностью, которые также являются водородными соединениями. В случае желудочно-кишечных расстройств по указанию врача следует принимать внутрь слабый раствор соляной кислоты или серную кислоту, которая, как известно, используется в автомобильных аккумуляторах.
1.2. Распространенность элементов и их роль в природных процессах
Основной объём литосферы сложен силикатными и алюмосиликатными горными породами. Подчинённое значение имеют породы карбонатные, фосфатные, сульфатные, галогенные, сульфидные, алюмооксидные, железооксидные и другие ещё более редкие химические типы.
Существенные различия в геохимической специализации имеются и внутри этих типов горных пород (деление силикатов на кислые и основные).
В кислых относительно повышены концентрации Li, Be, Rb, Tr, Ba, Tl, Th, U, Ta.
В основных – Cr, Sc, Ni, V, Co, Pt.
Часть элементов ведёт себя безразлично по отношению к изменению кремнекислотности горных пород.
Геохимические справочники содержат точные цифры кларков, вычисленных различными авторами. В практике геохимических исследований их точные значения бывают нужны не всегда. Но порядок этих значений для каждого элемента представлять необходимо.
Приведем порядок кларков различных элементов по В.Ф. Барабанову:
Более 10 000 г/т — O, Si, Al, Fe, Ca, Mg, Na, K.
1000-10 000 — Mn, Ti.
100-1000 — C, F, P, S, Cl, Rb, Sr, Zr, Ba.
10-100 — Pb, Th, Y, Nb, La, Ce, Nd, Li, B, N, Sc, V, Cr, Co, Ni, Cu, Zn, Ga.
1-10 — Eu, Dy, Ho, Er, Yb, Hf, Ta, W, Tl, U, Ge, As, Br, Mo, Sn, Sc, Pm, Sm, Be.
0,1-1,0 — Cd, Bi, In, Tu, I, Sb, Lu.
0,01-0,1 — Ar, Se, Ag, Hg.
0,001-0,01 — Re, Os, Ir, Ru, Rh, Pd, Te, Pt, He, Au.
По этой градации элементы, имеющие кларки выше 1000 г/т будут относиться к макроэлементам. Те, у которых кларки ниже – микроэлементы.
Учёт кларков безусловно необходим для правильного понимания закономерностей процессов миграции химических элементов. Различная распространённость элементов в природе имеет неизбежным следствием для многих из них наличие существенных различий в их поведении в лабораторных условиях и в природе. С уменьшением кларка снижается активная концентрация элемента, становится невозможным выпадение самостоятельной твёрдой фазы из водных растворов и других способов образования самостоятельных минеральных видов. Поэтому способность к самостоятельному минералообразованию зависит не только от химических свойств элемента, но и от его кларка. Химик в лаборатории для осуществления той или иной реакции берёт определённые (стехиометрические) соотношения реагирующих веществ, создавая тем самым условия, чтобы реакция прошла «до конца». В природе такие идеальные условия никогда строго не выдерживаются, и возможность осуществления тех или иных реакций, в части её зависимости от количественных соотношений реагирующих веществ, в значительной мере определяется кларками химических элементов.
Примеры:
S и Se – химически полные аналоги, а их поведение в природных процессах различно. S – ведущий элемент многих природных процессов. Сероводород играет большую роль в химических процессах, происходящих в донных осадках и в глубинах земной коры, в формировании месторождений ряда металлов. Сера формирует самостоятельные минералы (сульфиды, сульфаты). Селеноводород существенной роли в природных процессах не играет. Самостоятельные минералы класса селенатов и селенидов – уникальнейшая экзотика; селен находится в рассеянном состоянии как примесь в минералах, образуемых другими элементами. Аналогичны различия К и Cs, Si и Ge …